
分析 (1)一水合氨为弱碱,溶于水存在部分电离,依据化学平衡原理解释加入NH4Cl固体以及明矾后平衡移动方向以及pH的变化;
(2)醋酸与氢氧化钠恰好反应生成醋酸钠显碱性,若要溶液中c(H+)=c(OH-),则醋酸要过量;根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$计算;
(3)明矾中铝离子水解生成胶体具有吸附性,可净水;氯化铝水解生成氢氧化铝和盐酸,蒸干氯化氢挥发,促进水解得到氢氧化铝沉淀,灼烧氢氧化铝分解得到氧化铝.
解答 解:(1)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3•H2O?NH4++OH-,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,铵根浓度增大,
故答案为:NH3•H2O?NH4++OH-;降低;增大;
(2)醋酸与氢氧化钠恰好反应生成醋酸钠显碱性,若要溶液中c(H+)=c(OH-),则醋酸要过量,已知CH3COOH溶液和NaOH溶液的体积相同,则醋酸的浓度大于NaOH;已知溶液的pH=6,即c(H+)=10-6mol/L,Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=1.8×10-5,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18;
故答案为:>;18;
(3)明矾中铝离子水解生成胶体具有吸附性,则可对水质净化,水解离子反应为A13++3H2O?Al(OH)3(胶体)+3H+;AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3;
故答案为:A13++3H2O?Al(OH)3(胶体)+3H+;Al2O3.
点评 本题主要考查的是弱电解质的电离以及电离平衡的影响因素、有关电离常数的计算、盐的水解等,题目涉及的知识点较多,难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 7gCnH2n中含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCHCl3中含原子总数等于5NA | |
| C. | 1molC5H12分子中所含单键数为15NA | |
| D. | 标准状况下,11.2L已烷中含3mol碳原子 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
下列各组物质按右图所示转化关系每一步都能一步实现的是
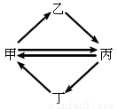
甲 | 乙 | 丙 | 丁 | |
A. | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B. | NO | HNO3 | NO2 | NH3 |
C. | Cu | CuO | CuSO4 | CuCl2 |
D. | Si | Na2SiO3 | SiO2 | SiF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 4:3:3 | C. | 8:6:9 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 2-甲基-3-戊炔 | |
| D. | 邻甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
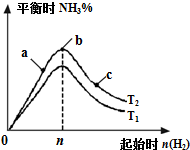 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 反应的影响,实验结果可表示成如图所示的规律(T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 反应的影响,实验结果可表示成如图所示的规律(T表示温度,n表示物质的量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “Cu-Zn-硫酸”原电池中,电子从Zn经过导线到达Cu,再经过溶液回到Zn形成闭合回路 | |
| B. | “Al-Mg-NaOH”原电池中,活泼型强的Mg失去电子,被氧化,做负极 | |
| C. | 理论上所有自发进行的氧化还原反应均可设计成原电池 | |
| D. | 已知铅蓄电池总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,可推负极是反应是 Pb-2e-=Pb2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com