
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.0.2mol铁粉与足量水蒸气反应生成的H2分子数为0.3NA |
| B.常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA |
| C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
B
解析试题分析:A、高温下铁与水蒸气反应的方程式为3Fe+4H2O(g)  Fe3O4+4H2,因此0.2mol铁粉与足量水蒸气反应生成的H2分子数为
Fe3O4+4H2,因此0.2mol铁粉与足量水蒸气反应生成的H2分子数为 NA,A不正确;B、过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,在反应中过氧化钠既是氧化剂,也是还原剂。其中氧元素的化合价从-1价部分升高到0价,部分降低到-2价,因此1mol过氧化钠在反应中转移1mol,则常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA,B正确;C、铜与浓硫酸反应的方程式为Cu+2H2SO4(浓)
NA,A不正确;B、过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,在反应中过氧化钠既是氧化剂,也是还原剂。其中氧元素的化合价从-1价部分升高到0价,部分降低到-2价,因此1mol过氧化钠在反应中转移1mol,则常温常压下,0.1mol Na2O2与CO2完全反应转移电子数为0.1NA,B正确;C、铜与浓硫酸反应的方程式为Cu+2H2SO4(浓)  CuSO4+2H2O+SO2↑,随着反应的进行硫酸的浓度逐渐降低,而稀硫酸与铜不反应。50mL18.4mol·L-1浓硫酸的物质的量=0.05L×18.4mol/L=0.92mol,与足量铜微热反应,生成SO2分子的数目小于0.46NA,C不正确;D、合成氨的反应是可逆反应,反应物的转化率达不到100%,因此某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6NA,D不正确,答案选B。
CuSO4+2H2O+SO2↑,随着反应的进行硫酸的浓度逐渐降低,而稀硫酸与铜不反应。50mL18.4mol·L-1浓硫酸的物质的量=0.05L×18.4mol/L=0.92mol,与足量铜微热反应,生成SO2分子的数目小于0.46NA,C不正确;D、合成氨的反应是可逆反应,反应物的转化率达不到100%,因此某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6NA,D不正确,答案选B。
考点:考查阿伏伽德罗常数的计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
NA表示表示阿伏伽德罗常数的值,下列说法正确的是
| A.1mol Na2O2粉末中含离子总数为4NA |
| B.22.4LCO2中含有的原子数为3NA |
| C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D.在一定量的稀硝酸中加入56g铁粉且完全溶解,转移的电子一定为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.7.8 g Na2O2中含有的离子总数目为0.4NA |
| B.1mol 苯分子中含有碳碳双键数目为3NA |
| C.标准状况下,将分子总数为NA的NH3和HCl气体混合后的体积约为22. 4L |
| D.16g CH4与18 g NH4+所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温下,23g NO2含有NA个氧原子 |
| B.1 L 0.1 mol·L-1的氨水含有0.1NA个OH- |
| C.标准状况下,22.4 L CCl4含有NA 个CCl4分子 |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液
甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )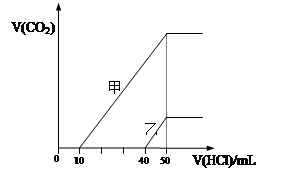
| A.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
| B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为: OH-+H+=H2O |
| C.乙溶液中含有的溶质是NaOH、NaHCO3 |
| D.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两种金属混合物19.6克,投入到一定量的盐酸中,反应完全后得到11.2L(标准状况)的氢气,此金属混合物不可能是
| A.Mg和Al | B.Al和Fe | C.Mg和Cu | D.Fe和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是 ( )
A.1∶2 B.2∶1 C.2∶3 D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为
| A.0.1(b-2a)mol/L | B.10(2a-b)mol/L | C.10(b-a)mol/L | D.10(b-2a)mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com