
可逆反应aX+2Y(g)?2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)﹣时间(t)图象如图。则下列说法中正确的是

A. 若X是固体,则t1时一定是增大了容器的压强
B. 若X是气体,则t2时不可能是减小容器压强
C. 若X是固体,则t1时可能是增大了X的质量
D. 若t2时采用了降温措施,则该反应的正反应方向△H>0
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:填空题
(10分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:_____ClO3-+______Fe2++______ =_____Cl-+_____Fe3++______
(3)FeCl3 在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2 Fe(OH)++H2O
Fe(OH)2++H+ K2 Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是

A.电池放电时Na+从a极区移向b极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为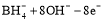

查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
一种新型净水剂PAFC(聚合氯化铁铝,[AlFe(OH)nCl6-n]m,,n<5,m<10},广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
A.PAFC用于净化饮用水时,可以除去水中所有的有害物质
B.PAFC中铁显+2价
C.PAFC可溶于盐酸
D.PAFC没有氧化性
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3+ + 2I- Fe2+ + I2
Fe2+ + I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3+ + SO42- + Ba2+ + 3OH- Fe(OH)3↓+ BaSO4↓
Fe(OH)3↓+ BaSO4↓
D.1L0.1mol/该溶液和足量的Zn充分反应,生成11.2gFe
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高一上10月月考化学试卷(解析版) 题型:填空题
(共18分)
(1)在同温同压下,等质量的CO和CO2,其体积之比为 ,电子数之比为 ,密度之比为 。
(2)9.5gMgCl2固体溶于水配成500mL溶液,其浓度为 mol·L-1,从中取出100mL溶液,其中Cl-的浓度为 mol·L-1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为 mol·L-1。
(3)某金属氯化物MCl2 27g ,含有0.40molCl- ,则该氯化物的物质的量为_ _____,摩尔质量为 ,金属M的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省莆田市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(16)为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓
盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;② 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
Na2O2+ HCl=== Cl2+ NaCl+H2O
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第一次月考化学试卷(解析版) 题型:选择题
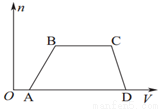
向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合液中慢慢通入CO2至过量,下列有关说法正确的是
A.整个过程中共发生四个离子反应。
B.根据现象可判断酸性强弱为:H2CO3>HAlO2>HCO3-
C.通入3molCO2和通入5molCO2都只产生3mol沉淀
D.整个过程中生成沉淀的物质的量与通入CO2的体积的图象如图所示:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com