
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后,排出气体,测出固体残留物中有两种成分,则该固体组成中一定含有( )
A.NaHCO3、Na2CO3 B.NaOH、Na2CO3
C.Na2O2、Na2CO3 D.Na2O2、NaOH
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题18烃及其有机物的命名练习卷(解析版) 题型:选择题
丁香油酚的结构简式是
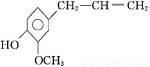 ,该物质不应有的化学性质是( )
,该物质不应有的化学性质是( )
①可以燃烧
②可以跟溴加成
③可以使酸性KMnO4溶液褪色
④可以跟NaHCO3溶液反应
⑤可以跟NaOH溶液反应
⑥可以在碱性条件下水解
A.①③ B.③⑥ C.④⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:填空题
硅酸钠是一种重要的无机功能材料,某研究性学习小组设计的利用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的流程如下:
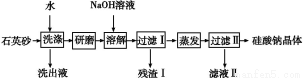
(1)石英砂加水洗涤的目的是 。
研磨后加入NaOH溶液溶解的离子方程式是 。
(2)实验室进行蒸发操作要用到的仪器有铁架台(含铁圈)、 和 。
(3)残渣Ⅰ的成分是 (填化学式)。将残渣Ⅰ溶于盐酸,再加入NaOH溶液得到沉淀,将该沉淀加入到NaClO和NaOH混合溶液中可制得一种优质净水剂,完成反应的离子方程式: + ClO-+ OH- + Cl-+ H2O
+ Cl-+ H2O
(4)按上述流程制得的硅酸钠晶体可表示为Na2O·nSiO2,若石英砂的质量为10.0 g,其中含SiO2的质量分数为90%,最终得到硅酸钠晶体15.2 g,则n= 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
下列实验操作及现象与实验结论一致的是( )
选项实验操作及现象实验结论
A向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀该溶液中不一定含有S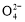
B光洁的铁钉放在冷的浓硫酸中,无明显现象铁钉与冷的浓硫酸不反应
C将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色氧化性:Br2>Fe3+>I2
D向浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1 的AgNO3溶液,产生的沉淀呈黄色 Ksp(AgCl)<Ksp(AgI)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
下列对物质用途的描述中,错误的是( )
A.铝可用于冶炼某些熔点较高的金属
B.Na2O2可用作漂白剂
C.碱石灰可用于干燥CO2、O2等气体
D.NaClO可用作消毒剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
用酸性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是( )
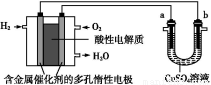
A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁—空气燃料电池工作原理示意图。下列有关该电池的说法正确的是( )
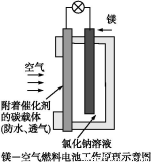
A.该电池Mg作负极,发生还原反应
B.该电池的正极反应式为:O2+2H2O+4e-=4OH-
C.电池工作时,电子通过导线由碳电极流向Mg电极
D.当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:填空题
某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+ 、Mg2+)作系列探究,装置如图所示:
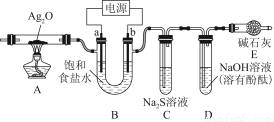
(1)电解时,甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因________________________________________________________________________。
(2)一段时间后,你认为C中溶液可能出现的现象是________________________,请用离子方程式表示原因______________________________________。
(3)实验结束后,乙同学将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加入到稀盐酸中却没有任何现象。请用化学方程式和简要的文字解释原因:________________________________________________________________________________________________________________________________________________。
(4)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去。他们对溶液红色褪去的主要原因提出了如下假设,请你完成假设二。
假设一:B中逸出的气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:___________________________________________________。
(5)请你设计实验验证上述假设一,写出实验步骤及结论:________________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
下列叙述正确的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com