
甲、乙代表2种金属,下列叙述中,不能判断金属活动性甲比乙强的是
| A.常温下,甲能从水中置换出氢,而乙不能 |
| B.最高价氧化物对应的水化物碱性比较,甲比乙的强 |
| C.甲与非金属反应时失电子比乙少 |
| D.甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡 |
C
解析试题分析:A.在金属活性性顺序表中,活泼的金属能把水会酸中是H置换出来,而活动性弱的金属不能把水或酸中是H置换出来,因此能作为判断金属活动性甲比乙强的依据。正确。B.元素的金属性越强,其最高价氧化物对应的水化物碱性就越强,元素的金属性越弱,其最高价氧化物对应的水化物的碱性就越弱。因此可以作为比较甲比乙的金属性强的依据。正确。C.要比较金属活动性的强弱,应该看金属原子失去电子的难易,而不是金属原子失去电子的多少,因此不能作为判断金属活性性强弱的依据。错误。D.一般情况下,有活动性不同的金属与电解质溶液形成原电池时,活动性强的金属作负极,发生氧化反应;活动性弱的金属作正极,在正极上发生还原反应。所以甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡,能证明活动性甲>乙。正确。
考点:考查判断金属活动性强弱的方法的知识。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:单选题
下列实验方案不能达到预期目的的是( )
| A.用钠、镁分别与水反应,可证明钠、镁的金属性强弱 |
| B.用氯化镁、氯化铝分别于浓氨水反应,可证明钠、镁的金属性强弱 |
| C.用铁、石墨与硫酸铜溶液组成的原电池,可证明铁、铜的金属性强弱 |
| D.把氯气通入溴化钠的水溶液中,看到溶液呈橙色,可证明氯、溴的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。
| A.①②③ | B.只有⑤ | C.①②③④⑤ | D.①② |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3;
2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断错误的是
A.氧化性:MnO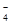 >Cl2>Fe3+ >I2 >Cl2>Fe3+ >I2 |
| B.FeCl3既有氧化性又有还原性 |
| C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为6FeI2+3Cl2=2FeCl3+4FeI3 |
| D.FeCl3能使湿润的淀粉碘化钾试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验对应的结论正确的是:
| | A | B | C | D |
| 装 置 | 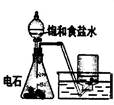 | 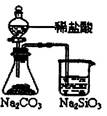 | 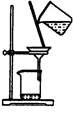 | 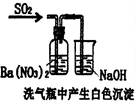 |
| 结 论 | 实验室制取乙炔 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶 液反应生成的碘 | 白色沉淀是BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是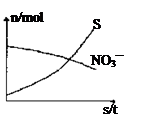
| A.配平后氧化剂与还原剂的化学计量数之比为1:4 |
| B.硫元素在反应中被还原 |
| C.还原剂是含NH4+的物质 |
| D.若生成1molNH4+,则转移电子2mol。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是( )
| A.MFe2O4表现了还原性 |
| B.MFe2Ox表现了还原性 |
| C.SO2和NO2表现了还原性 |
| D.SO2和NO2发生了分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将0.195g锌粉加入到20.0 mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1∶1∶1时,实际参加反应的FeS与HNO3的物质的量之比为( )。
| A.1∶6 | B.16∶25 | C.2∶11 | D.1∶7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com