
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
 | |||
 | |||
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.图8所知反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C.若在图7所示的平衡状态下,再向体系中充入He,此时v正>v逆
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.为了消除碘缺乏病,在食盐中必须加入一定量的单质碘
B.新制氯水中含有的分子包括Cl2、H2O,含有的离子包括H+、Cl-、ClO-
C.新能源汽车的推广与使用有助于减少光化学烟雾的产生
D.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | D | G | |||||
| 3 | E | C | H | |||||
| 4 | F | I |
(1)写出相应元素符号:A: E: G: H: 。
(2)第ⅠA中碱性最强的物质是 (化学式);第ⅦA族中最高价氧化物对应水化物酸性最强的是
(化学式)。
(3)写出C的单质与NaOH溶液反应的离子方程式: 。
(4)写出H的单质置换出I的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子组在指定溶液中能大量共存的是
A.中性溶液:Cu2+、Al3+、NO3-、SO42-
B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
C.加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42-
D.常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A.原子半径的大小顺序: r(X)>r(Y)>r(Z)>r(R)
B.含有Y、Z、R三种元素的化合物最多只有2种
C.元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂
D.Y与Z形成的两种化合物中的化学键和晶体类型均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 ▲ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。
|
 写出该电池的负极反应式: ▲ 。
写出该电池的负极反应式: ▲ 。 (3)CO2和H2充入一定体积的密闭容器中,在两种温度
下发生反应:
CO2(g) +3H2(g) CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
|
|
(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 ▲ 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图11。在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为 ▲ (填序号)。
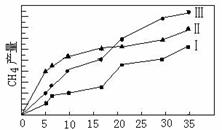
|
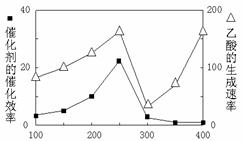
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图12。
①乙酸的生成速率主要取决于温度影响的范围是 ▲ 。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
N、O、Si、S是重要的非金属元素,下列说法正确的是
A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱
B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质
C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应
D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应及耗用氯气的量是(设乙烯为1mol ,反应产物中的有机物只是四氯乙烷)
A.取代,4 mol Cl2 B.加成,2 mol Cl2
C.加成、取代,5 mol Cl2 D.加成、取代,3 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W | X | |
| Y | Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com