
| A. | 氧化反应先于还原反应发生 | |
| B. | 一定有电子转移(得失或偏移) | |
| C. | 有单质生成或参加的反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
分析 A.氧化还原反应中,氧化反应和还原反应同时发生;
B.氧化还原反应的实质为电子转移(得失或偏移);
C.有单质参加的反应不一定为存在元素化合价变化,则不一定属于氧化还原反应;
D.化合反应不一定存在元素化合价变化,则不一定为氧化还原反应.
解答 解:A.在氧化还原反应中,氧化反应与还原反应不会分开进行,二者同时进行,故A错误;
B.任何氧化还原反应中都一定存在电子转移(得失或偏移),此为氧化还原反应的实质,故B正确;
C.有单质生成或参加的反应不一定是氧化还原反应,如白磷转化成红磷、金刚石转化成石墨等,反应中不存在元素化合价变化,则不属于氧化还原反应,故C错误;
D.氧化还原反应中必须存在化合价变化,而化合反应中不一定存在化合价变化,如氧化钙与水、三氧化硫与水的反应都是化合反应,由于没有化合价变化,则不属于氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握氧化还原反应与四种基本反应类型之间的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 半导体材料砷化镓 | B. | 吸氢材料镧镍合金 | ||
| C. | 荧光材料硫化锌 | D. | 超导材料K3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)分别取等物质的量的金属钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是1:2:3.
(1)分别取等物质的量的金属钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是1:2:3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中有机物均可以发生还原反应 | |
| B. | ②中有机物可用饱和Na2CO3溶液鉴别 | |
| C. | ③中有机物均可以发生水解反应 | |
| D. | ③中有机物均属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
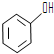 和
和 ,应选用a(填字母).
,应选用a(填字母).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每消耗1mol Na2CO3就会放出22.4LCO2 | |
| D. | 每生成1molNa2S2O3,转移4mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com