
分析 由①原溶液加过量的NaOH溶液,产生白色沉淀,可知一定含Mg2+,不含Cu2+;且CO32-、Mg2+不能共存,则一定不含CO32-;
②原溶液中加BaCl2溶液不产生沉淀,则一定不含SO42-;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,白色沉淀为AgCl,一定含Cl-,以此来解答.
解答 解:由①原溶液加过量的NaOH溶液,产生白色沉淀,可知一定含Mg2+,不含Cu2+;且CO32-、Mg2+不能共存,则一定不含CO32-;
②原溶液中加BaCl2溶液不产生沉淀,则一定不含SO42-;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,白色沉淀为AgCl,一定含Cl-,
(1)原溶液中一定含有的离子是Mg2+、Cl-,一定不含有的离子是CO32-、SO42-、Cu2+,可能含有的离子是Na+,
故答案为:Mg2+、Cl-; CO32-、SO42-、Cu2+; Na+;
(2)实验③可以省略,因溶液呈电中性,必须同时含有阴、阳离子,又因为一定无CO32-,SO42-,所以一定有Cl-,
故答案为:是;溶液呈电中性,必须同时含有阴、阳离子,又因为一定无CO32-,SO42-,所以一定有Cl-;
(3)由溶液显电中性,可知0.1mol/L×2+c(Na+)=0.3mol/L,解得c(Na+)=0.1mol/L,故答案为:0.1mol/L;
(4)由上述分析可知,溶液含Cl-、Na+、Mg2+,加过量NaOH使镁离子转化为沉淀,则过滤后溶液中溶质为NaCl、NaOH,故答案为:NaCl、NaOH.
点评 本题考查无机物的推断,为高频考点,把握离子的检验、离子之间的反应等为解答的关键,侧重分析与推断能力的考查,注意溶液电中性的应用,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1 molN2与足量的氢气反应合成氨,转移的电子数为6 NA | |
| B. | 常温下,1.0LpH=13的氢氧化钡溶液中OH-的数目为0.2NA | |
| C. | 常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数一定为0.3NA | |
| D. | 1L0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
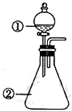 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硫酸 | 用砂纸打磨过的铝条 | 产生刺激性气味气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molHCl溶液中,H+数目为NA | |
| B. | 常温常压下,8gCH4含有电子数目为5NA | |
| C. | 12gNaHSO4晶体中含有0.3NA个阳离子 | |
| D. | 78g苯含有C=C双键的数目为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com