
| A. | 一定温度下,稀释0.1mol/L的CH3COOH溶液,KW不变,Ka将增大 | |
| B. | 对FeCl3溶液进行稀释时,Fe3+水解程度将增大,故溶液的酸性将增强 | |
| C. | 可根据Ksp的数值大小直接比较难溶物在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl悬浊液中加入KI固体,有黄色沉淀生成 |
分析 A.温度一定离子积常数和电离平衡常数不变,弱电解质存在电离平衡,加水稀释促进电离;
B.氯化铁溶液中铁离子水解溶液显酸性,加入水稀释促进水解,离子浓度减小;
C.比较不同类型的难溶物的溶解度大小,必须通过计算溶解度比较,不能通过溶度积直接比较,比较同类型的难溶物的溶解度大小,可通过溶度积直接比较溶解度大小;
D.反应向着更难溶的方向进行.
解答 解:A.温度一定离子积常数和电离平衡常数不变,弱电解质存在电离平衡,加水稀释促进电离,一定温度下,稀释0.1mol/L的CH3COOH溶液,KW不变,Ka不变,故A错误;
B.氯化铁溶液中铁离子水解溶液显酸性,加入水稀释促进水解,离子浓度减小,酸性减弱,故B错误;
C.阴阳离子之比相同的难溶物可以用溶度积常数比较溶解性,比较不同类型的难溶物的溶解度大小,必须通过计算溶解度比较,不能通过溶度积直接比较,故C错误;
D.25℃时,Ksp(AgCl)>Ksp(AgI),说明氯化银溶解度小于碘化银,向AgCl悬浊液中加入KI固体,有黄色沉淀碘化银生成,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡、盐类水解、沉淀溶解平衡的影响因素分析,注意平衡常数随温度变化,题目难度中等.


科目:高中化学 来源: 题型:选择题
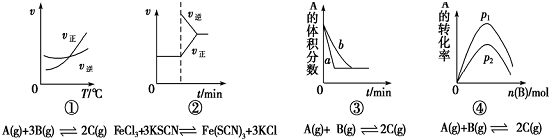
| A. | 图①是其他条件一定时反应速率随温度变化的图象,图象表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移 | |
| B. | 图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化 | |
| C. | 图③可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响 | |
| D. | 图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
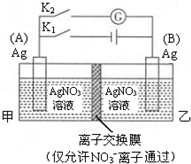
| A. | 闭合K1,断开K2后,A电极增重 | |
| B. | 闭合K1,断开K2后,乙池溶液中Ag+浓度增大 | |
| C. | 断开K1,闭合K2后,B电极发生氧化反应 | |
| D. | 断开K1,闭合K2后,NO3-向A电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色 | B. | 乙醇与浓硫酸共热至170℃ | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 在液溴与苯的混合物中撒入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
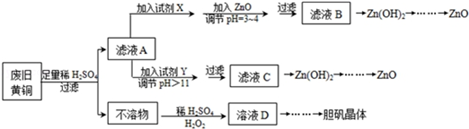
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电器起火,立即用水扑灭 | |
| B. | 炒菜时油锅着火,立即盖上锅盖 | |
| C. | 厨房煤气管道漏气,立即关闭阀门并开窗通风 | |
| D. | 图书管内图书着火,立即用液态二氧化碳灭火器扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 | |
| D. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com