
分析 (1)I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H=+206.0kJ•mol-1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=-129.0kJ•mol-1,
Ⅰ-Ⅱ得:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H,依据盖斯定律计算反应热;
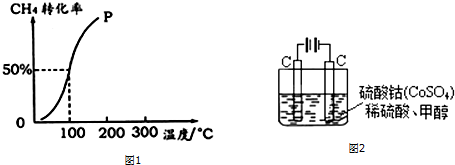
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量;
①根据c=$\frac{\frac{△n}{V}}{△t}$计算v(H2);
②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;
(3)其他条件不变,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③依据燃料电池中燃料在负极失电子发生氧化反应,结合电荷守恒配平书写电极反应,依据化学方程式计算消耗氢氧化钾物质的量.
解答 解:(1)I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H1=+206.0kJ•mol-1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H2=-129.0kJ•mol-1,
Ⅰ-Ⅱ得:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H,依据盖斯定律::△H=+206.0kJ/mol-(-129.0kJ/mol)=+77.0 kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77.0 kJ•mol-1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,
故答案为:0.003 mol•L-1•min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数K=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案为:2.25×10-4;
(3)A.平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡$\frac{c(H{\;}_{2})}{c(C{H}_{3}OH)}$减小,故D正确;
E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误;
故答案为:CD;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+;
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,甲醇在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,则电池负极的电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,依据化学方程式计算分析2CH3OH+3O2+4KOH→2K2CO3+6H2O,净化含1mol甲醇的水燃料电池需消耗KOH物质的量2mol;
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;2.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池等,掌握基础是解本题的关键,题目难度中等.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
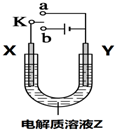
| A. | 若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则Y极上有气泡放出 | |
| B. | 若X、Y、Z分别为铁片、铜片、氯化铜溶液,开关K与a连接,则溶液中Cu2+向Y极移动 | |
| C. | 若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则溶液中Cu2+向Y极移动 | |
| D. | 若X、Y、Z分别为石墨、石墨、氯化铜溶液,开关K与b连接,则 Y极上有黄绿色气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 香柠檬醚分子式为C13H9O4 | |
| B. | 香柠檬醚最多可与7 mol H2发生加成反应 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.80L | B. | 58.24L | C. | 80.64L | D. | 116.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾净化水 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用装有硅胶的透气小袋防潮 | |
| D. | 屠呦呦用乙醚从中药中萃取青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:金刚石>干冰 | B. | 稳定性:SiH4>H2S | ||
| C. | 碱性:KOH>Al(OH)3 | D. | 离子半径:O2->Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com