
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:______________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或 “不正确”)。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A.分液法 B.蒸馏法 C.结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 ,生成HCl的物质的量共为 。
【答案】(1) CH4+Cl2 ![]() CH3Cl+HCl,正确;(2)干燥气体;(3) KI-淀粉;(4)A;(5)3mol,3mol。
CH3Cl+HCl,正确;(2)干燥气体;(3) KI-淀粉;(4)A;(5)3mol,3mol。
【解析】
试题分析:(1)甲烷和氯气发生取代反应,生成一氯代烷的方程式为:CH4+Cl2 ![]() CH3Cl+HCl,有可能是氯气和水反应产生HCl,故此同学说法正确;(2)盛放的是浓硫酸,利用浓硫酸的吸水性,作干燥剂,即干燥Cl2;(3)蓝色一般可能是无水硫酸铜与水变蓝,也可能是淀粉与碘单质变蓝,根据装置图,只能是淀粉遇碘变蓝,因此棉花上淀粉-KI溶液,利用氯气把碘置换出来;(4)有机物为卤代物,不溶于水,可以采用分液的方法进行分离,故选项A正确;(5)设CH3Cl为xmol,则CH2Cl2为x+0.1,CHCl3为x+0.2,CCl4为x+0.3,根据碳原子守恒,x+x+0.1+x+0.2+x+0.3=1,解得x=0.1,因此消耗氯气的物质的量为(0.1+0.2×2+0.3×3+0.4×4)mol=3mol,消耗氯气的物质的量等于生成HCl物质的量,即3mol。
CH3Cl+HCl,有可能是氯气和水反应产生HCl,故此同学说法正确;(2)盛放的是浓硫酸,利用浓硫酸的吸水性,作干燥剂,即干燥Cl2;(3)蓝色一般可能是无水硫酸铜与水变蓝,也可能是淀粉与碘单质变蓝,根据装置图,只能是淀粉遇碘变蓝,因此棉花上淀粉-KI溶液,利用氯气把碘置换出来;(4)有机物为卤代物,不溶于水,可以采用分液的方法进行分离,故选项A正确;(5)设CH3Cl为xmol,则CH2Cl2为x+0.1,CHCl3为x+0.2,CCl4为x+0.3,根据碳原子守恒,x+x+0.1+x+0.2+x+0.3=1,解得x=0.1,因此消耗氯气的物质的量为(0.1+0.2×2+0.3×3+0.4×4)mol=3mol,消耗氯气的物质的量等于生成HCl物质的量,即3mol。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)③⑤⑥⑦中原子半径最大的是 (用元素符号表示,下同),②③④⑤的简单离子中半径最小的是 。
(2) ③⑤中元素的金属性强弱顺序为 ,⑥⑦元素的非金属性强弱顺序为
(3)①、②两种元素按原子个数比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)碳酸钠溶液呈碱性的原因 。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10molL-1氨水的电离度为1.32%,下列有关叙述正确的是( )

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的现象描述正确的是
A.氢气在氯气中燃烧,火焰呈淡蓝色,瓶口出现大量暈白雾
B.将新制的氯气通入AgNO3溶液中,白色沉淀生成.
C.铜在氯气中燃烧,产生大量棕色的烟,加水溶解后可得蓝绿色溶液
D.用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,如果取0.1molL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1molL-1NaOH溶液中由水电离出的OH-浓度之比为_________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH _____7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排 列顺序为_________(填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
(2)清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=-105kJmol-1.向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_________;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________;
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e=2O2-)

①c电极为_________正极,d电极上的电极反应式为_________;
②图乙是用惰性电极电解100mL 0.5molL-1 CuSO4溶液,a电极上的电极反应式为_________;若a电极产生56mL(标准状况)气体,则所得溶液的pH=_________(不考虑溶液体积变化),若要使电解质溶液 恢复到电解前的状态,可加入_________(选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S![]() HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);

(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)1000ml某待测溶液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式: 。
(2)待测液中肯定不存在的阳离子是 。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在 (填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由: 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是 。
②沉淀A中能与稀硝酸反应的成分是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的以离子形式存在的碘元素。下图是实验室从海藻中提取碘的流程的一部分。
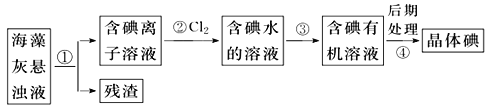
下列判断正确的是( )
A. 步骤①、③的操作分别是过滤、萃取
B. 可用硝酸银溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是裂化汽油或四氯化碳
D. 步骤④的操作是过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com