
| A. | 乙烯与溴化氢混合 | B. | 将乙烯通入溴的四氯化碳溶液中 | ||
| C. | 乙烷与溴蒸气混合 | D. | 将乙炔通入溴的四氯化碳溶液中 |
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 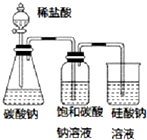 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 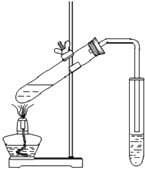 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 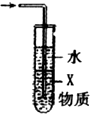 图中X若为CCl4,可用于吸收NH3或HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA | |
| D. | 1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和C2H4体积一定相等 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
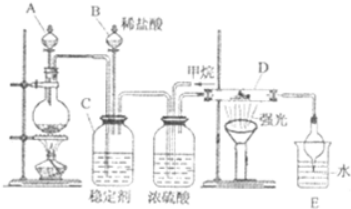 氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:
氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O | |
| B. | 硫酸铝溶液与足量烧碱:Al3++3OH-=Al(OH)3↓ | |
| C. | 氯化亚铁溶液中滴入氯水Cl2+2Fe2+═2Cl-+2Fe3+ | |
| D. | 金属铝投入NaOH溶液中2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+2H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com