
下列各组原子中,化学性质一定相似的是
| A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子 |
| C.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |
C
解析试题分析:A、原子核外电子排布式为1s2为He,原子核外电子排布式为1s22s2为Be,二者性质不同,故A错误;B、原子核外M层上仅有两个电子的X为Mg元素,原子核外N层上仅有两个电子的Y可能为Ca、Sc、Ti、V、Fe、Co、Ni、Zn等元素,但价电子数不同,性质不相同,故B错误;C、2p轨道上只有一个电子的X为B元素,3p轨道上只有一个电子的Y为Al,二者位于周期表同一主族,最外层电子数相同,性质相似,故C正确;D、最外层都只有一个电子的X、Y原子,可能为H与碱金属元素,性质有相似地方,都具有还原性,但与ⅠB族元素性质不同,虽然最外层也有1个电子,故D错误,故选C。
考点:考查原子的结构和元素的性质


科目:高中化学 来源: 题型:单选题
下列叙述中正确的是
| A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高 |
| B.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多 |
| C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M |
| D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层电子都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是
| A.R的原子半径比Z的大 |
| B.R的氢化物的热稳定性比W的强. |
| C.X与Y形成的化合物只有一种 |
| D.Y的最高价氧化物的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8。下列说法错误的是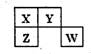
| A.Z元素的氧化物对应水化物的酸性一定弱于W |
| B.四种元素中Z的原子半径和形成的离子半径均最大 |
| C.X、Z、W中最简单气态氢化物稳定性最弱的是Z |
| D.X、Y、Z的原子均能与氢原子形成四原子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.这四种离子的电子层结构相同,因而离子的性质也就相同
B.原子序数:b>a>c>d
C.最高价氧化物对应水化物的碱性:B>A
D.气态氢化物的稳定性:D>C
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质性质的说法错误的是
| A.热稳定性:HCl> HI | B.原子半径:Na> Mg |
| C.酸性:H2SO3>H2SO4。 | D.结合质子能力:S2-> Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com