
【题目】下列事实不能用勒夏特列原理解释的是
A. 工业合成氨中,将氨气液化分离以提高氨气产率
B. 开启啤酒瓶后,瓶中马上泛起大量泡沫
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 盛有2mL5%H2O2溶液的试管中滴入1mL0.1mol·L-1FeCl3溶液,试管中迅速产生大量气泡
科目:高中化学 来源: 题型:
【题目】化学小组利用如图装置进行某些气体的制备和性质实验,图中夹持装置有省略 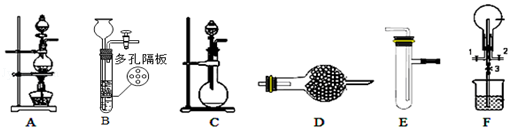
(1)为制取干燥氨气,可将装置C与装置D连接,则装置D中的固体可选用 . a.碱石灰b.无水氯化钙 c.五氧化二磷d.生石灰
(2)装置F可用于探究氯气和氨气反应,实验时打开开关1、3,关闭2,先向烧瓶中通入一种气体,然后关闭1、3,打开2,向烧瓶中缓慢通入另一种气体.实验一段时间后烧瓶内出现浓厚的白烟后在容器内壁凝结,并产生一种单质气体.写出足量氨气与氯气反应的化学方程式 . 请设计一个实验方案鉴定该固体中的阳离子 .
(3)利用装置A、E,可设计实验比较氯离子和溴离子的还原性强弱,能证明结论的实验现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实际应用原理的表达式中,不正确的是
A. 用排饱和食盐水法收集Cl2: Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. H2燃烧热的热化学方程式:H2 (g)+1/2O2 (g) =H2O(1) △H=-285.8kJ·mol-1
C. 热的氢氟酸酸性增强:HF+H2O= H3O++F- △H>0
D. 用 TiCl4制备 TiO2:TiCl4+(x+2)H2O (过量)![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜(如图)改进国外的纯碱生产工艺,生产流程可简要表示如图: 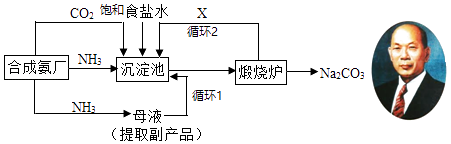
该生产纯碱的方法称联合制碱法或侯德榜制碱法联合制碱法或侯德榜制碱法,在制得纯碱的同时,还可得到一种副产品.
(1)上述沉淀池中发生的化学反应方程式是 , 实验室分离出沉淀的操作是 , 该操作使用的玻璃仪器有;
(2)写出上述流程中X物质的分子式;
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了的循环(填上述流程中的编号1、2);
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,还需要的试剂有;
(5)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品.通氨气的作用有 .
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3 , 提高析出的NH4Cl纯度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1L0.1mol·L—1的氨水中含有的NH3分子数为0.1NA
B.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA
C.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4 NA
D.常温常压下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)芒硝的化学式是_________________。
(2)以氯化钠、石灰石、水为原料制取漂白粉,写出有关反应的化学方程式。
①______________________________;②_________________________________;
③______________________________;④_________________________________。
(3)元素铬(Cr)在溶液中主要以Cr3+、Cr2O72—(橙红色)、CrO42—(黄色)CrO2—等形式存在。回答下列问题:
①![]() 与
与![]() 的化学性质相似。写出向
的化学性质相似。写出向![]() 溶液中加入过量
溶液中加入过量![]() 溶液反应的离子方程式_____________________________________________。
溶液反应的离子方程式_____________________________________________。
②![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,该反应的离子方程式为 ______________________________________________________。
,该反应的离子方程式为 ______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com