
| A.①② | B.①④ | C.②③ | D.③④ |
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.向盛有少量浓硫酸的量筒中缓慢加入一定量的水并搅拌,可得稀硫酸 |
| B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.蒸馏操作时,应将温度计水银球插入液面下 |
| D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | — | 315 | — |
| 熔点/℃ | -70.0 | — | — | — |
| 升华温度/℃ | — | 180 | 300 | 162 |
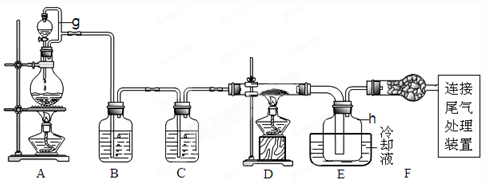
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
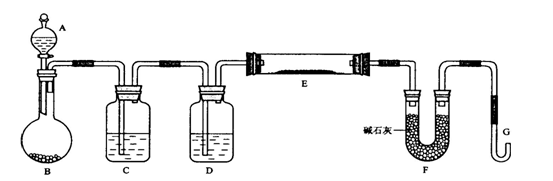
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用pH试纸测定某一溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较 |
| B.过滤时,漏斗里液体的液面要高于滤纸的边缘 |
| C.胶头滴管的管口直接伸入试管里滴加液体,以免外溅 |
| D.实验室取用液体药品做实验时,如没有说明用量,一般取1~2 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.Fe2(SO4)3 | B.Fe(NO3)3 | C.FeCl3 | D.FeBr3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 | ① |
| 2.在加热后的溶液中滴加酚酞,并在上方滴一些植物油 | ②利用植物油隔绝 |
| 实验方法 | 观察到的现象和结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。 | 浓度大的溶液中酚酞红色会消失,则证明红色消失与氢氧化钠溶液的浓度大小有关 |
| 方案二:向原红色消失的溶液中加 ① (填试剂名称) | ② |
查看答案和解析>>
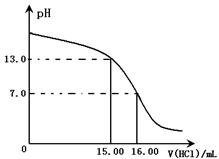
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱:盐酸>碳酸>苯酚 |
| B.除去溴苯中的少量溴:加入KI溶液,充分反应后,弃去水溶液 |
| C.实验室只用乙醇和乙酸混合加热就可以制取乙酸乙酯 |
| D.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液,加热后用硫酸酸化,再滴加硝酸银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com