
| A. | CH4,H2O2,NH3 | B. | H2O,CO2,Na2O2 | C. | Na2O,NaCl,MgCl2 | D. | NaOH,NaClO,Na2O |
分析 一般来说,活泼金属与非金属元素之间形成离子键,非金属元素之间形成共价键,以此来解答.
解答 解:A.CH4、NH3中只含极性键,H2O2中含有极性键和非极性键,化学键类型不完全相同,故A不选;
B.H2O、CO2中只含极性键,Na2O2中含有非极性键和离子键,化学键类型不完全相同,故B不选;
C.Na2O,NaCl,MgCl2中均只含离子键,化学键类型不完全相同,故C选;
D.NaOH、NaClO含有极性键和离子键,Na2O中只含离子键,化学键类型不完全相同,故D不选;
故选C.
点评 本题考查化学键,把握离子键、共价键的形成及化学键的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
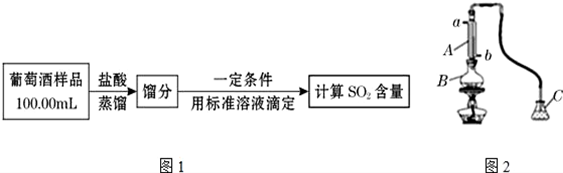
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液具有碱性,可用作消毒剂和漂白剂 | |
| B. | 氢氟酸具有酸性,可用于玻璃的腐蚀剂 | |
| C. | 过氧化钠具有漂白性,可作航空和潜水的供氧剂 | |
| D. | 活性铁粉具有还原性,在食品袋中可用作除氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D、E两种元素仅可组成化学式为E2D的化合物 | |
| B. | 原子半径:E>F>C>D | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性:D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
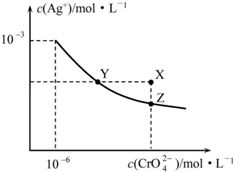
| A. | 在t℃时,Ag2CrO4的Ksp=1×10-9 | |
| B. | X点有Ag2CrO4沉淀生成 | |
| C. | 通过加热蒸发可以使溶液由Y点变到Z点 | |
| D. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苯中加入浓溴水和铁粉,加热,再加入AgNO3溶液,产生沉淀,说明苯和浓溴水发生了取代反应 | |
| B. | 实验室制备的乙炔气体通常具有一定的刺激性气味,依次通过NaOH溶液、浓硫酸洗气,获得纯净的乙炔 | |
| C. | 向2%的AgNO3溶液中逐滴滴加2%的氨水,直至产生的白色沉淀恰好消失,即配制得到银氨溶液 | |
| D. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01 mol/(L•s) | B. | v(NO)=0.08 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.001 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 醋酸纤维、硝化纤维、合成纤维、光导纤维都可由纤维素在一定条件下制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com