
【题目】根据所学知识,完成下面题目:
(1)写出表示含有8个质子,10个中子的原子的化学符号: .
(2)根据下列微粒回答问题: ![]() H、
H、 ![]() H、
H、 ![]() H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
②互为同位素的是 .
③质量数相等的是和 , 中子数相等的是和 .
(3)相同物质的量的14CO2与S18O2的质量之比为;中子数之比为;电子数之比为 .
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是: . (铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为 .
【答案】
(1)![]() O
O
(2)6;5;![]() H、
H、 ![]() H、
H、 ![]() H;14C;14N;14C;16O
H;14C;14N;14C;16O
(3)23:34;2:3;11:16
(4)Li或Na
(5)10:9
【解析】解:(1)含有8个质子的元素是O,质量数=质子数+中子数=8+10=18,因此化学符号为 ![]() O,所以答案是:
O,所以答案是: ![]() O;(2)①质子数和中子数只要其一不相同就属于不同核素:
O;(2)①质子数和中子数只要其一不相同就属于不同核素: ![]() H、
H、 ![]() H、
H、 ![]() H、14C、14N、16O、分别为一种核素,共6种,
H、14C、14N、16O、分别为一种核素,共6种, ![]() H、
H、 ![]() H、
H、 ![]() H都属于氢元素,14C属于碳元素,14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,所以答案是:6;5;②
H都属于氢元素,14C属于碳元素,14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,所以答案是:6;5;② ![]() H、
H、 ![]() H、
H、 ![]() H都属于氢元素,质子数相同,而中子数不同互为同位素,所以答案是:
H都属于氢元素,质子数相同,而中子数不同互为同位素,所以答案是: ![]() H、
H、 ![]() H、
H、 ![]() H;③原子符号左上角的数字为质量数,则质量数相等的是14C和14N,14C中中子数=14﹣6=8,16O 的中子数=16﹣8=8,所以二者中子数相同,所以答案是:14C;14N; 14C;16O;(3)根据m=nM,相同物质的量的14CO2与S18O2的质量比为摩尔质量比即46:68=23:34,14CO2中1个碳原子含8个中子、6个质子,1个氧原子含有8个质子,8个中子,1个14CO2中含中子数为24,含质子数为22,S18O2中1个硫原子含有16个质子,16个中子,1个氧原子含有8个质子、10个中子,1个S18O2中含中子数为36,含质子数为32,所以相同物质的量的14CO2与S18O2的中子数之比为24:36=2:3,分子质子数等于电子数,所以两者电子数之比为22:32=11:16,所以答案是:23:34;2:3;11:16;(4)0.2g氢气的物质的量为:
H;③原子符号左上角的数字为质量数,则质量数相等的是14C和14N,14C中中子数=14﹣6=8,16O 的中子数=16﹣8=8,所以二者中子数相同,所以答案是:14C;14N; 14C;16O;(3)根据m=nM,相同物质的量的14CO2与S18O2的质量比为摩尔质量比即46:68=23:34,14CO2中1个碳原子含8个中子、6个质子,1个氧原子含有8个质子,8个中子,1个14CO2中含中子数为24,含质子数为22,S18O2中1个硫原子含有16个质子,16个中子,1个氧原子含有8个质子、10个中子,1个S18O2中含中子数为36,含质子数为32,所以相同物质的量的14CO2与S18O2的中子数之比为24:36=2:3,分子质子数等于电子数,所以两者电子数之比为22:32=11:16,所以答案是:23:34;2:3;11:16;(4)0.2g氢气的物质的量为: ![]() =0.1mol,则 2M+2H2O═2MOH+H2↑,
=0.1mol,则 2M+2H2O═2MOH+H2↑,
2 1
0.2mol 0.1mol
则合金的平均摩尔质量为:M= ![]() =39g/mol,
=39g/mol,
铷的相对原子量取85.5,则铷的摩尔质量为85.5g/mol,则另一种碱金属的摩尔质量一定小于39g/mol,
故另一碱金属可能是Li或Na,
所以答案是:Li或Na;(5)质量相同的H2O和D2O的物质的量之比为 ![]() :
: ![]() =10:9,由2Na+2H2O=2NaOH+H2↑、2Na+2D2O=2NaOD+D2↑,可知H2、D2的物质的量之比等于H2O和D2O的物质的量之比,即H2、D2的物质的量之比为10:9,相同体积气体体积之比等于其物质的量之比,故H2、D2的体积之比为10:9,所以答案是:10:9.
=10:9,由2Na+2H2O=2NaOH+H2↑、2Na+2D2O=2NaOD+D2↑,可知H2、D2的物质的量之比等于H2O和D2O的物质的量之比,即H2、D2的物质的量之比为10:9,相同体积气体体积之比等于其物质的量之比,故H2、D2的体积之比为10:9,所以答案是:10:9.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】温室效应引起国际的关注,我国也积极应对,采取措施。中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是( )
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料的使用也会产生白色污染
D.聚二氧化碳塑料与干冰都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.草酸可使酸性高锰酸钾溶液褪色,其离子方程式为:2MnO ![]() +5C2O
+5C2O ![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
B.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO ![]() +2Ba2++5OH﹣=2BaSO4↓+NH3?H2O+AlO
+2Ba2++5OH﹣=2BaSO4↓+NH3?H2O+AlO ![]() +2H2O
+2H2O
C.NaHSO3溶液与FeCl3反应的离子方程式:SO ![]() +2Fe3++H2O=SO
+2Fe3++H2O=SO ![]() +2Fe2++2H+
+2Fe2++2H+
D.NH4HCO3溶液中加入少量NaOH:NH4++OH﹣═NH3?H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
(1)基态Ni的外围电子排布式为
(2)比较C、N、Al的第一电离能(用元素符号表示)
(3)比较Cu、Al、C的最高价氧化物的沸点由高到低顺序为(用化学式表示)
(4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式
(5)Ni为电池中常见的材料,以Al和NiOOH为电极,NaOH为电解液组成电池,放电时NiOOH转化为Ni(OH)2写出电池的总反应
(6)Ca和F形成的某离子晶体结构如图所示,Ca2+的配位数为 . 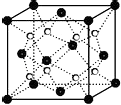
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,RO﹣与R﹣可发生反应:RO ![]() +5R﹣+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R﹣+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A.元素R位于周期表中第ⅤA族
B.RO ![]() 中的R只能被还原
中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO ![]() 参与该反应,则转移的电子的物质的量为5 mol
参与该反应,则转移的电子的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: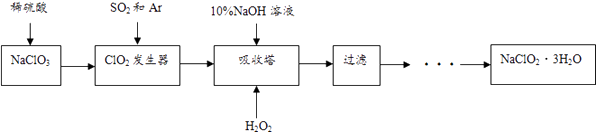
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O
②纯ClO2常温下为气体,易分解爆炸,一般用稀有气体或空气稀释到10%以下安全
(1)10%的NaOH溶液的密度为1.2g/cm3其物质的量浓度为 .
(2)在ClO2发生器中当1gSO2完全转化时,放出akJ热量,写出该热化学反应方程式鼓入Ar的作用是 .
(3)写出吸收塔内发生的化学反应方程式 . 吸收塔的温度不能超过40℃,其目的是 .
(4)从滤液中得到的NaClO23H2O粗晶体中往往含有杂质,要得到更纯的NaClO23H2O晶体方法是 .
(5)工业处理含NaClO2废水时,先向废水中加入适量NaOH,用惰性电极电解该废水,同时制得NaClO3 , 写出ClO2﹣在阳极放电时的电极反应方程式 .
(6)已知SO2和Ar的混合气体中,SO2的百分含量为5.6a%,当bL(标况下)该混合气体参加反应时,理论上需要的17%的H2O2的质量为g(结果必须化简).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( ) 
A.用装置甲制取氯气
B.用装置乙除去氯气中混有的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl24H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 , E的基态原子的外围电子排布式为 .
(2)B、C、D三种元素的第一电离能由小到大的顺序为 .
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为
(4)下列叙述正确的是(填序号).a.M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=﹣221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某同学对该固体进行了如下实验,下列判断正确的是( ) 
A.白色沉淀乙不一定是Al(OH)3
B.气体甲一定是纯净物
C.固体X中一定存在(NH4)2SO4、MgCl2
D.固体X中一定存在FeCl2、AlCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com