
| A. | Fe2(SO4)3 | B. | KNO3 | C. | Na2SO4 | D. | FeSO4 |
分析 Cu与稀硫酸不反应,硝酸盐在酸性条件下具有硝酸的强氧化性,则可使Cu溶解,由发生的氧化还原反应可知生成的气体,以此来解答.
解答 解:A.Cu、稀硫酸、硫酸铁混合时,铜和硫酸铁发生氧化还原反应,生成硫酸亚铁和硫酸铜,造成铜粉的质量减少,但没有气体,故A错误;
B.Cu、稀硫酸、KNO3混合时发生3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,则铜粉质量减轻,同时溶液逐渐变为蓝色,且有气体逸出,故B正确;
C.Cu、稀硫酸、Na2SO4混合时不反应,故C错误;
D.Cu与稀硫酸不反应,加入FeSO4混合时不反应,但Cu不溶解,故D错误.
故选B.
点评 本题考查硝酸盐在酸性条件下的性质,明确选项中各物质的性质及发生的化学反应是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | 参加反应的Fe2+全部作还原剂 | |
| C. | 每生成1molFe3O4,反应转移电子的总物质的量为4mol电子 | |
| D. | 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中的氧化剂Cl2,氧化产物是KCl | |
| B. | 氧化性由强到弱顺序为 Cl2>KClO3>Br2 | |
| C. | 反应③中的HNO3体现了酸性和氧化性 | |
| D. | 反应③中有0.4mol HNO3参加反应时,转移电子物质的量为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
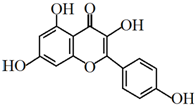 山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )| A. | 结构式中含有羟基、醚键、酯基、碳碳双键 | |
| B. | 可发生取代反应、水解反应、加成反应 | |
| C. | 可与NaOH反应,不能与NaHCO3反应 | |
| D. | 1 mol山萘酚与溴水反应最多可消耗4 mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、SO42-、K+、Cl- | B. | Na+、NH4+、NO3-、Fe3+ | ||
| C. | K+、CO32-、Cl-、Br- | D. | Ba2+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
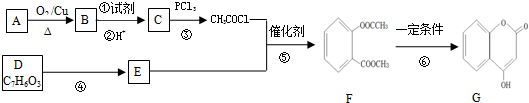
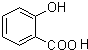 、
、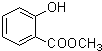 .
.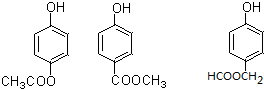 (写出一种即可).
(写出一种即可).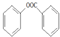 )是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线
)是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
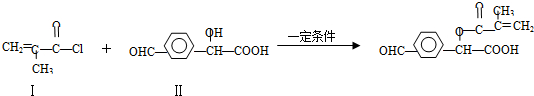
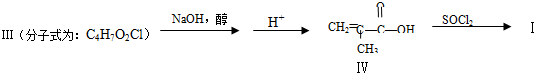
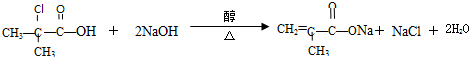 .
.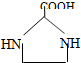 与足量的化合物Ⅰ在一定条件下也能发生类似反应①的反应,生成有机化合物Ⅵ,则Ⅵ的结构简式为
与足量的化合物Ⅰ在一定条件下也能发生类似反应①的反应,生成有机化合物Ⅵ,则Ⅵ的结构简式为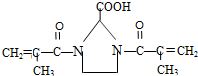 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| B. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| C. | 用氢氧焰可以加热软化玻璃制玻璃器皿,这利用了氢气和氧气化合时放出的热量 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com