解:(1)反应中C元素的化合价由+2价降低为-2价,则CO为氧化剂,CO完全燃烧生成二氧化碳,而CH
4O完全燃烧生成二氧化碳和水,则放出的热量多,即△H
1>△H
2,故答案为:CO;>;
(2)CO(g)+2H
2(g)?CH
4O(g),
开始0.5 1 0
转化0.3 0.6 0.3
平衡0.2 0.4 0.3
则0~10min内的平均速率v(H
2)=
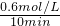
=0.06mol/(L.min),
化学平衡常数K=
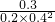
=9.375(mol/L)
-2,
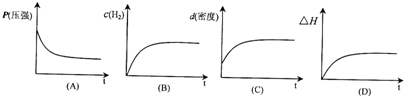
由反应可知,随反应的进行,P在减小,氢气的浓度在减小,密度不变,反应为放热反应,△H在变小,则只有图象A符合,
开始在相同容积的密闭容器中充入2molCO和4molH
2,则反应达到平衡后,压强增大,平衡正向移动,则CO的转化率增大,
故答案为:0.06mol/(L.min);9.375(mol/L)
-2;A;增大;
(3)①甲酸为弱酸,稀释时Ka不变,则
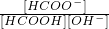
=
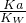
,则比值不变,故答案为:C;
②25℃,将pH=1的HCOOH溶液和pH=1的HC1溶液等体积混合,氢离子的物质的量为原来的2倍,但溶液的体积为原来的2倍,则Qc=Ka,所以电离平衡HCOOH?HCOO
-+H
+不移动,故答案为:C;混合后溶液中Qc=Ka.
分析:(1)反应中C元素的化合价由+2价降低为-2价,CO完全燃烧生成二氧化碳,而CH
4O完全燃烧生成二氧化碳和水,则放出的热量多;
(2)CO(g)+2H
2(g)?CH
4O(g),利用三段法计算出各个量,然后计算反应速率和化学平衡常数;
由反应可知,随反应的进行,P在减小,氢气的浓度在减小,密度不变,反应为放热反应,△H在变小;
(3)①甲酸为弱酸,稀释时Ka不变,则
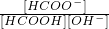
=
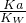
;
②25℃,将pH=1的HCOOH溶液和pH=1的HC1溶液等体积混合,Qc=Ka.
点评:本题考查知识点较多,为综合题,涉及氧化还原反应、反应与能量、化学平衡及计算、电离平衡等,注重高考常考考点的考查,题目难度中等.

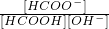 与稀释前比较______(填字母)
与稀释前比较______(填字母)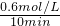 =0.06mol/(L.min),
=0.06mol/(L.min),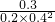 =9.375(mol/L)-2,
=9.375(mol/L)-2,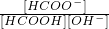 =
=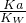 ,则比值不变,故答案为:C;
,则比值不变,故答案为:C;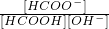 =
=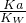 ;
;

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案

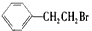 通过消去反应制备I的化学方程式_____________________(注明反应条件)。
通过消去反应制备I的化学方程式_____________________(注明反应条件)。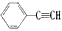 和H2二者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有____(双选,填字母)。
和H2二者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应。下列关于Ⅵ和Ⅶ的说法正确的有____(双选,填字母)。