
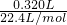 ≈0.014mol,
≈0.014mol, ×100%≈70%,故答案为:过滤;洗涤;SO2+Br2+2H2O=2HBr+H2SO4;70%;
×100%≈70%,故答案为:过滤;洗涤;SO2+Br2+2H2O=2HBr+H2SO4;70%; 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
(16分)工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是 。
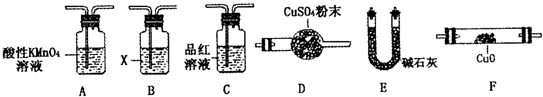
乙同学认为气体Y中除含有SO2、H2外,还可能含有CO2气体。为此设计了下列探究实验装置。图中夹持仪器省略,M中盛有澄清石灰水。
①认为气体Y中还含有CO2的理由是 (用化学方程式表)。
②装置A中试剂的作用是 。
③为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
④能说明气体Y中含有H2的实验现象是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省高三11月月考理科综合试题(化学部分) 题型:实验题
(16分)工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是 。
乙同学认为气体Y中除含有SO2、H2外,还可能含有CO2气体。为此设计了下列探究实验装置。图中夹持仪器省略,M中盛有澄清石灰水。

①认为气体Y中还含有CO2的理由是 (用化学方程式表)。
②装置A中试剂的作用是 。
③为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
④能说明气体Y中含有H2的实验现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com