
【题目】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为_________________________。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
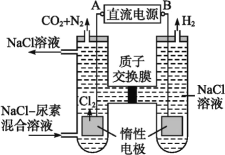
①电源的负极为________(填“A”或“B”)。
②阳极室中发生的反应依次为__________________________、____________________________。
③电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
【答案】2NH3+CO2![]() CO(NH2)2+H2O B 2Cl--2e-═Cl2↑ CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl 不变 7.2
CO(NH2)2+H2O B 2Cl--2e-═Cl2↑ CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl 不变 7.2
【解析】
(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,配平书写方程式;
(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,化学方程式为:2NH3+CO2==CO(NH2)2+H2O,故答案为: 2NH3+CO2==CO(NH2)2+H2O,
①由图可知,左室电极产物为CO2和N2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源的负极,故答案为:B;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-═Cl2↑ ,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
故答案为:2Cl--2e-═Cl2↑ ,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl ;
③根据上述反应式可以看出在阴、阳极上产生的OH、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
电解收集到的13.44L气体,反应可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]=0.12mol×60gmol1=7.2g,
故答案为:不变;7.2.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A (g)+2B(g)![]() 2C (g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是
2C (g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是
A. 增大压强 B. 减少B的浓度 C. 减少A的浓度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称为保险粉,常作还原剂,能溶于冷水,难溶于乙醇,在碱性介质中稳定。
Ⅰ.用甲酸钠(HCOONa)生产保险粉的工艺流程如图:
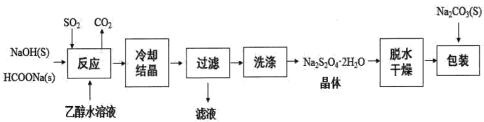
回答下列问题:
(1)Na2S2O4中硫元素的化合价为_____________。
(2)“滤液”中可以循环利用的物质是__________。
(3)“洗涤”所用试剂最好为_________ (填序号)。
a.冰水 b.热水 c.无水乙醇 d.90%乙醇水溶液
(4)“反应”在70℃条件下进行,写出发生反应的化学方程式_______。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_______。
Ⅱ.探究保险粉的性质
(6)现将0.05mol·L-1Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:
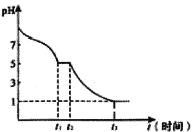
①t1时溶液中含硫元素的粒子浓度由大到小的顺序___________________。
②t2→t3段发生反应的离子方程式为_______________。
(7)取少量连二亚硫酸钠在隔绝空气的条件下加强热使其完全分解,得到Na2SO3、Na2S2O3和一种气体(STP),该反应中氧化产物、还原产物的物质的量之比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L 0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的 物质的量分数与溶液pH的关系如图乙所示,(已知HA=H++HA- HA- ![]() H++A2-)则下列说法中正确的是( )
H++A2-)则下列说法中正确的是( )
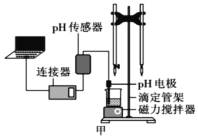
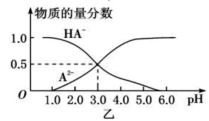
A.pH=3.0时,可以计算出Ka2= 10 -3
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验左边的滴定管为碱式滴定管,用来盛装NaOH溶液,烧杯中并加酚酞作指示剂
D.常温下,将等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是科技、生产、生活中应用最广泛的金属材料。

现有铁、铝的混合物进行如下实验:
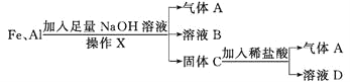
(1)操作X的名称是_____。
(2)气体A是_____。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
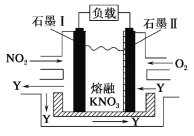
A.放电时,NO![]() 向石墨Ⅱ电极迁移
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO![]()
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com