
下图是某煤发电厂处理废气的装置示意图。下列说法错误的是( )

A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的反应可表示为2SO2+2CaCO3+O2=2CaSO4+2CO2
D.可用酸性高锰酸钾溶液检验废气处理是否达标
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是 ,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是 ,最高价氧化物水化物显两性的氢氧化物的化学式是 。
(2)③与④的气态氢化物的稳定性由大到小的顺序是 。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
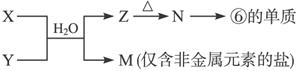
X溶液与Y溶液反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
药物贝诺酯可由乙酰水杨酸和对-乙酰氨基酚在一定条件下反应制得:
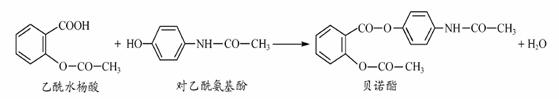
有关上述反应物和产物的叙述不正确的是( )
A.上述三种有机物中共有四种含氧官能团
B.贝诺酯分子中有9种不同化学环境的氢原子
C.贝诺酯与足量NaOH(aq)共热,最多消耗NaOH 4mol
D.可用FeCl3(aq) 区别乙酰水杨酸和对-乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
在阿司匹林的结构简式中①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共煮时,发生反应时断键的位置是( )

A.①④ B.②⑤ C.③④ D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构式,下列推断不正确的是( )
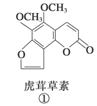
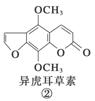
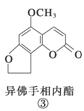

A.①与②、③与④分别互为同分异构体
B.①、③互为同系物
C.等物质的量②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者多
D.①、②、③、④均能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石) ΔH=+11.9kJ·mol-1 可知,金刚石比石墨稳定
C.在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
CCTV的《动物世界》栏目备受全国观众的喜爱,在拍摄水下动物的生活习性时,人们需要带上呼吸面具。下列物质最适合用于该面具的是( )
A.纯碱 B.食盐 C.氧化钠 D.过氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(1)写出元素T在元素周期表中的位置 ▲ 。
(2)元素Y与元素Z相比,金属性较强的是 ▲ (用元素符号表示),下列表述中能证明这一事实的是 ▲ (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ▲ ,该物质中含有的化学键是 ▲ 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 ▲ 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于 ▲
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com