
金属-硫电池价格低廉,使用寿命较长,能量密度高,因而在电池研究领域得到广泛关注。最近,我国科研工作者研究了一种能在室温下工作的新型Na-S电池。该电池放电过程的总反应方程式如下:nS + 2Na = Na2Sn
注:能量密度指单位质量的电极材料可输出的电能,以W·h·kg-1为计量单位。
则下列说法不正确的是( )
A.该电池中用固态金属Na为负极,S单质作为正极,但S单质须负载在导电材料上
B.该电池的电解质必须具备室温下传导Na+的能力,但不宜用NaOH溶液作为电解液
C.n值越大则该电池的能量密度越高
D.该电池充电过程中阳极的电极反应式:Na2Sn-2e-=2Na+ + nS,故充电时Na+从阳极向阴极迁移
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:2015-2016学年江西省高一上学期10月月考化学试卷(解析版) 题型:填空题
O2和O3是氧元素的两种单质,根据其化学式完成下列各题:
①等质量的O2和O3所含分子个数比为________,原子个数比为________,分子的物质的量之比为________。
②等温等压下,等体积的O2和O3所含分子个数比为________,原子个数比为________,质量比为________。
查看答案和解析>>
科目:高中化学 来源:2016届山西怀仁第一中学高三上学期期中考试化学试卷(解析版) 题型:填空题
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造。
(1)粉红色、不溶于水的Co(OH)2具有两性,其溶于盐酸的离子方程式为_ ,Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3,反应的化学方程式为______________________。
(2)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为_ 。
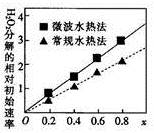
②两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。由图中信息可知:_ 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果较好的是_ 。
(3) CoCl2常用作多彩水泥的添加剂,可用钴的氧化物(其中Co的化合价为+2、+3)制备,用480 mL 5 mol·L-1盐酸恰好将其完全溶解,得到CoCl2溶液和6.72 L(标准状况下)黄绿色气体。则该钴的氧化物的化学式为_ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高二上期中考试化学试卷(解析版) 题型:选择题
进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
A.(CH3)2CHCH2CH2CH3
B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2
D.(CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源:2015-2016安徽蚌埠第二中学高二上学期期中考试化学试卷(解析版) 题型:选择题
某物质在空气中完全燃烧时,生成水和二氧化碳的分子数比为2:1,则该物质可能是( )
①CH4 ②C2H4 ③C2H5OH ④CH3OH
A.②③ B.①④
C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2016届山西康杰中学等四校高三上第二次联考理化学试卷(解析版) 题型:填空题
钡盐生产过程中排出大量钡泥【主要含有BaCO3、BaSO3、Ba(FeO2)2等】,某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:
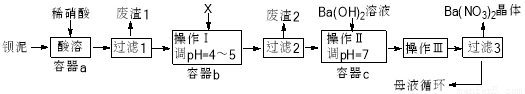
已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理____________。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为_______。
(3)结合本厂生产实际X试剂应选下列中的_____。
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)废渣2为________。
(5)操作III为_______。
(6)过滤III后的母液应循环到容器______中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
一般情况下,前者无法决定后者的是( )
A.原子核外电子排布——元素在周期表中的位置
B.化合物熔融状态是否导电——化合物是否为离子化合物
C.分子间作用力的大小——分子稳定性的强弱
D.物质内部储存的能量高低——化学反应的热效应
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次月考理综化学试卷(解析版) 题型:填空题
条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I. N2(g)+3H2(g) 2NH3(g)△H=-90.0kJ/mol
2NH3(g)△H=-90.0kJ/mol
II. 2N2(g)+6H2O(l) 4NH3(g)+3O2(g)△H=+1530.0kJ/mol
4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式 。
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如图(图中所示数据均为初始物理量)
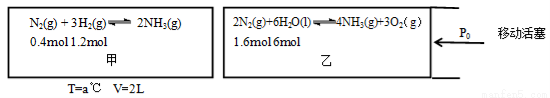
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解)
①该条件下甲容器中的K= ;平衡时,甲的压强P平= (用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= ;
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
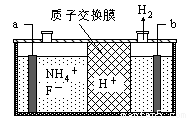
a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知 N2O4(g) 2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
①25℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
②0℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
a.加深 b.变浅 c. 不变 d.无法判断
(5)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s) Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com