B
分析:A.根据1个水分子中含有3个原子计算原子个数;
B.根据质量、摩尔质量、分子数、原子数、阿伏伽德罗常数之间的关系计算;
C.常温常压下,气体摩尔体积不是22.4L/mol;
D.NaCl为强电解质完全电离,根据公式n=C×V计算;
解答:A.1mol水的分子数为 N
A个,一个水分子中含有3个原子,所以1mol水中含有的原子数为3N
A,故A错误;
B.32g O
2含的物质的量为n=

=
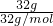
=1mol,1个O
2分子中含有2个原子,所以32g O
2含有的氧原子数为2N
A,故B正确;
C.常温常压下,气体摩尔体积不是22.4L/mol,所以11.2LCl
2的物质的量不是0.5mol,所含分子数不是0.5N
A,故C错误;D.1L 0.1 mol?L
-1 NaCl溶液中n(NaCl)=C×V=0.1 mol?L
-1×1L=0.1mol,NaCl为强电解质完全电离,所以1L 0.1 mol?L
-1 NaCl溶液中所含的Na
+数为0.1N
A,故D错误;
故选B.
点评:本题考查了阿伏加德罗常数的判断,注意气体摩尔体积的应用,物质的量与质量的换算关系,题目难度不大.

 =
=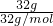 =1mol,1个O2分子中含有2个原子,所以32g O2含有的氧原子数为2NA,故B正确;
=1mol,1个O2分子中含有2个原子,所以32g O2含有的氧原子数为2NA,故B正确;
