
下列混合物的分离或提纯操作中不正确的是
A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B.除去Fe(OH)3胶体中混有的Cl- 离子,可用渗析的方法
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶、滴定操作都可用于提纯物质
科目:高中化学 来源:名师精品推荐(解析版) 题型:?????
下列各物质中物质的量最多的是 (NA表示阿伏加德罗常数)
A.2NA个H2O
B.常温常压下,48g O2
C.标准状况下,22.4L H2
D.0.5mol CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下期末化学试卷(解析版) 题型:选择题
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe( OH)2。以下说法正确的是
OH)2。以下说法正确的是
A.负极发生的反应为:Fe-2e-===Fe2+
B.正极发生的反应为:2H2O+O2+2e-===4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在水面处更容易腐蚀
查看答案和解析>>
科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
在一定条件下,A、B、C、D之间可发生如下转化关系:A+B→C+D+H2O(未配平),且该过程为非氧化还原反应,则气体C不可能是
A.NH3 B.CO2 C.SO2 D.NO2
查看答案和解析>>
科目:高中化学 来源:2016届江西省九江市七校高三第一次联考化学试卷(解析版) 题型:选择题
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:
CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2===CH3COOH+H2O
D.正极上发生的反应为:O2+4e-+2H2O===OH-
查看答案和解析>>
科目:高中化学 来源:2016届河南省三门峡市高三上学期第一次精英对抗赛化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A、硫酸铝溶液与过量Ba(OH)2溶液反应
2Al3+ + 3SO42- +3 Ba2++8OH-=3BaSO4↓+2A1O2- +4H2O
B、碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:
CO32-+2H+=CO2↑+H2O
C、酸性高锰酸钾溶液与H2O2溶液混合:
2MnO4-+3H2O2+6H+=2Mn2++6H2O+402↑
D、氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二第一学期第一次月考化学试卷(解析版) 题型:填空题
(9分)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
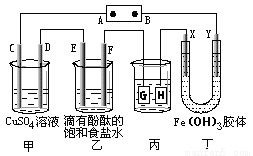
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:简答题
(9分)高铁酸钠是一种高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品。反应方程式为:
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
(1)上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是 。
(2)高铁酸钠电池是一种新型可充电电池,电解质为NaOH溶液,放电时负极材料为Zn,正极产生红褐色沉淀,写出该电池反应方程式 。
(3)生产高铁酸钠的原料之一Fe(NO3)3用黑色粉末Fe(含有Fe3O4)与稀硝酸反应制备。准确称取该黑色粉末13.12g,加入200mL 4 mol·L-1 HNO3搅拌,固体完全溶解,共收集到标准状况下2688mL的气体,经分析其中只含有NO,并测得此时溶液中c(H+)=0.4mol·L-1(设反应前后溶液体积不变)。通过以上数据,计算该黑色粉末中Fe的质量分数。(写出计算过程,结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期二调化学试卷(解析版) 题型:选择题
根据下图海水综合利用的工业流程图,判断下列说法正确的是
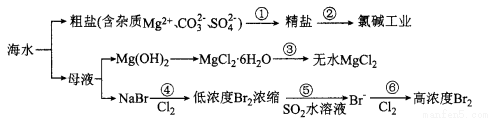
已知:MgCl2.6H20受热生成Mg(OH) Cl和HC1气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2.6H20灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br一需消耗2.24LCl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com