
电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
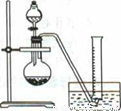
实验原理:CaC2 +2H2O==Ca(OH)2+C2H2 ↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①称取样品1.2g;
②把1.2g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平;
④作为反应器的烧瓶中有24mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽 、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,反应的化学方程式为□KMnO4+□C2H2+□H2SO4——□K2SO4+□MnSO4+□CO2+□ 。若该实验生成的 C2H2完全被KMnO4溶液氧化,至少需0.1 mol·L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
(1)圆底烧瓶;分液漏斗;量筒
(2)500
(3)336;使量筒内外液面相平、视线与量筒内液面的最低处相切
(4)2,1,3,1,2,2,4,H2O;300
(5)80%
【解析】
试题分析:(1)从装置图中可以看出,玻璃仪器还有圆底烧瓶、分液漏斗和量筒。
(2)量筒中收集到气体360mL,因此应选择500mL的量筒。
(3)因为反应容器中的液体会使反应器中原有的空气进入量筒,因此收集到气体的体积为360mL-24mL=336mL。量筒读数时应注意使量筒内外液面相平,视线与量筒内液面的最低处相切。
(4)反应中,Mn的化合价由+7降至+2,降低5价,C的化合价由-1升至+4,升高5价,根据氧化还原反应得失电子守恒及原子守恒,可配平方程式。根据方程式可知:2KMnO4~C2H2,乙炔的物质的量为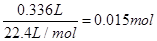 ,则需要高锰酸钾溶液的体积为
,则需要高锰酸钾溶液的体积为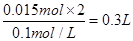 ,即300mL。
,即300mL。
(5)电石的纯度为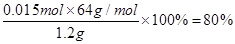 。
。
考点:考查实验仪器,实验操作,实验数据处理,氧化还原反应配平等。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com