
����Ŀ����Ʒ�ˮ�г�����NaCN����ҵ�Ϲ涨�京������0.5 mg/L�ſ��ŷţ���NaCN����ķ�ˮ��������������������

��֪��HCN�����Ա�̼������������о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ��
��ش��������⣺
(1)��һ������ʱ����Һ��pHӦ����Ϊ______������������������������������������ԭ����___________����Ӧ�У���ʹ1 mol NaCN��ΪNaOCN������Ҫ������NaClO����Ϊ________mol��
(2)д���ڶ�������ʱ������Ӧ�����ӷ���ʽ��_____________________����Ӧ�б�������Ԫ����__________��
(3)����10 m3��NaCN 10.3 mg��L�ķ�ˮ��ʵ��������NaClO__________g��ʵ������ӦΪ����ֵ��4����������ʹ��ˮ��NaCN�����ﵽ�ŷű���
���𰸡�(1)���ԣ���ֹ����HCN�������Ա�ж�����Ⱦ������1��
(2) 2OCN- +3C1O- =CO2��+CO32-+3Cl-+N2����������![]() ����(3) 1490��
����(3) 1490��
��������
�����������1��������Ϣ��HCN�о綾����˵���pHΪ���ԣ���ֹ����HCN�������Ա�ж�����Ⱦ������NaOCN��C�� �� 4�ۣ�NaCN��C�� �� 2�ۣ����ݵ�ʧ������Ŀ�غ㣬1 �� (4��2)=n(NaClO) �� 2��n(NaClO)=1mol��(2)����II�����ӷ�Ӧ����ʽΪ��2OCN�� �� 3ClO��=CO2�� �� CO32�� �� 3Cl�� �� N2�������ݻ��ϼ۵ı仯����������Ԫ�ص��ǵ���(3)���ݵ�ʧ������Ŀ�غ㣬10 �� 10 �� (10.3��0.5) �� 10��3 �� (2 �� 3)/49=n(NaClO) �� 2��n(NaClO)=5mol��ʵ������ӦΪ����ֵ��4�������ʵ�����ĵ�n(NaClO)=20mol��m(NaClO)=1490g��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ľ���֬����м�ϴ�Գ�ȥ����Ĥ������ϴ�����Һ�е����Գ�����ʽ���գ���ü��������Լ�(����)
A����ˮB��CO2
C��NaOHD��HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ������ ��
A�� 3-��-2-�һ�����
3-��-2-�һ�����
B����CH3��3CCH2CH��C2H5��CH3 2��2-����-4-�һ�����
C�� �ڼ�����
�ڼ�����
D�� 2-��-3-��Ȳ
2-��-3-��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ѿ�������ơ�
��1����������֭�������ǵķ����ǣ������мӼ�������ԣ��ټ������Ʊ���Cu��OH��2�����ȣ���������_______________________________________��
��2����������ƹ����У�������ת��Ϊ�ƾ��Ĺ������£�����������л�ѧ����ʽ��
C6H12O6�������ǣ�![]() 2________+2C2H5OH
2________+2C2H5OH
��3�����Ѿ��ܷⴢ�����������������ζ��������Ҳ����ͨ��
��ѧʵ�����Ʊ���ʵ��������ͼ��ʾװ���Ʊ�����������

���Թ�a���������������Ļ�ѧ����ʽ�� ________________________________��
���Թ�b��ʢ�ŵ��Լ��DZ���_________________��Һ��
��ʵ�鿪ʼʱ���Թ�b�еĵ��ܲ�����Һ���µ�ԭ����___________________��
����������Թ�b�����ɵ�������������Ҫ�õ���������____������ţ���
a��©�� b����Һ©�� c������©��
��4��ij�л���Ľṹ��ʽΪHOOC��CH=CHOH����֤���л����к���-COOH�����ų����õķ����� ������������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������н������·�Ӧ��![]()
![]()
![]() ��5min�ڰ�������������1.7g����Ӧ����Ϊ �� ��
��5min�ڰ�������������1.7g����Ӧ����Ϊ �� ��
A��![]()
B��![]()
C��![]()
D��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ԭ�Ƕȷ��������з�Ӧ��ˮ��������ͬ����
�� Na��H2O �� NO2��H2O �� Cl2��H2O �� Na2O2��H2O
A���٢ڢ� B���٢ڢ� C���٢ۢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨ�Ѳ��ֱ��ʵĹ���������Ʒ�Ĵ��ȣ������ͼ��ʾ��ʵ��װ�ã�ͼ��QΪ�������õ�����������ҩƷ��Ӧ������ȡһ��������Ʒ��������������ͼ��ʾ��װ�ð�װ����������Һ©���Ļ�������ϡ������������С�

��ش��������⣺
��1��Q�ڷ�����Ӧ����________�����壬
���еķ�Ӧ��________��Ϊ������ԭ��Ӧ��
��2��Ϊ�ⶨ��Ӧʱ������������������ϡH2SO4ǰ����ر�________���K1������K2����K3��������______���K1������K2����K3������
��3����������Ӧֹͣʱ����K1��K2��K3���رգ�Ȼ���ȴ�K2���ٻ�����K1����ʱ�ɹ۲쵽�������� ��
��4��b��װ�Ĺ����Լ���__________���軺����K1��ԭ��Ϊ ��
��5��ʵ�����ʱ����Ͳ������x mLˮ����Ͳ�����ռ���y mL���壬��������ƵĴ����� ���ú�x��y��ʽ�ӱ�ʾ�����������������ɱ�״������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 500 g CuSO 4 ��Һ�в��������缫��һ��Ϊͭ��һ��Ϊ��ͭ����п����ͨ��������ͭ�պ�ȫ���ܽ������ʱͭ���������� 7.04g���������Һ�������� 0.02g�����ͭ�к�п������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ϻ�ijС���ϣ���ž�սʿΪ��Ѱ�Һ��ʵ�����ˮԴ���Ե���ɽȪˮ���з������飬�����ʾˮ��Ӳ��Ϊ28��(����Ӳˮ������Ҫ�������ӡ�þ���ӡ������Ӻ���������ӡ���˼���������⣺
��1����Ȫˮ����________Ӳˮ(��д����ʱ�������á�����
��2����Ҫ��ȥCa2����Mg2��������ˮ�м���ʯ�Һʹ���Լ�����ʱ�ȼ�________���________��ԭ����______________________��
��3��Ŀǰ���������ӽ�����֬��NaR��HR������ˮ����������ʹ��HR��Ϊ�����ӽ�����֬����ˮ�е�Ca2����Mg2���뽻����֬��________�����ӽ������á���ʹ��NaR��Ϊ�����ӽ�����֬��ʧЧ��ɷ���5%��8%________��Һ��������
��4�����ϻ������ú�ˮ��������õ�ˮ�������Ǻ�ˮ���õ���������õ�ˮ��ԭ��ͼ����֪��ˮ�к�Na����Cl����Ca2����Mg2����SO�����ӣ��缫Ϊ���Ե缫��������������⣺
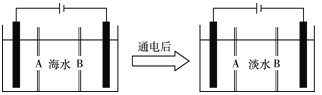
�� �����ӽ���Ĥ��ָ________(��A��B����
��д��ͨ����������ĵ缫��Ӧʽ��__________���������������ǣ�____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com