
| 高温高压 |
| 催化剂 |
| 时间/h 物质的量/mol |
0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
| 一定条件 |
| 通电 |
| △c |
| △t |
| ||
| 高温高压 |
| 1 |
| 2 |
| ||
| 2h |
| 1.2mol |
| 6.0mol |
(
| ||||
|
| 2 |
| 138.24 |
| 1 |
| K |
| 138.24 |
| 2 |
| ||
| 高温高压 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、在pH=1的溶液中,Cu2+、Fe2+、NO3-和SO42-能大量共存 |
| B、用惰性电极电解饱和氯化钠溶液的离子方程式:2Cl-+2H+=H2↑+Cl2↑ |
| C、镁铝合金被碱液腐蚀时,负极反应式为:Mg-2e-=Mg2+ |
| D、检验某未知溶液中是否含SO42-时,应先加盐酸酸化,再加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| C | Al箔插入稀硝酸中 | 开始无现象 | Al箔表面被硝酸氧化钝化,形成致密的氧化膜 |
| D | 向浓度均为0.1mol?L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
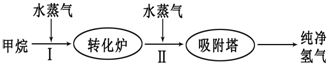

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2CO2(g)+N2(g)△H<0
2CO2(g)+N2(g)△H<0| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) |
1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) |
3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 |
T(℃) | NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 |
| B、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水 |
| C、用分液法分离C2H5OH与H2O的混合物 |
| D、测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,V升 SO3含氧原子个数是3VNA/22.4 |
| B、0.1molCnH2n+2中含有的C-C键数为0.1×n×NA |
| C、常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA |
| D、1 mol Cl2发生反应时,转移的电子数一定是2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com