
����ѪҺ���������ƽ�⣺CO2��H2O H2CO3
H2CO3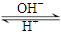 HCO3��ʹ����ѪҺpHֵ������7.35��7.45֮�䣬����ͻᷢ�����ж�����ж�����pHֵ��c(HCO3��):c(H2CO3)�仯��ϵ���±���ʾ��������˵������ȷ����
HCO3��ʹ����ѪҺpHֵ������7.35��7.45֮�䣬����ͻᷢ�����ж�����ж�����pHֵ��c(HCO3��):c(H2CO3)�仯��ϵ���±���ʾ��������˵������ȷ����
|
c(HCO3��):c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
|
pH |
6.10 |
7.35 |
7.40 |
7.45 |
A����������ѪҺ�У�HCO3����ˮ��̶�С�ڵ���̶�
B�����巢�����ж�ʱ��������̼�����ϻ���
C��pH=7.00��ѪҺ�У�c(HCO3��)��c(H2CO3)
D.������pH=7.40��ѪҺϡ����pH=7.35��c(H��)��c(OH��)һ������
D
��������
���������A������ѪҺpHֵ������7.35��7.45֮�䣬��˵��HCO3����ˮ��̶ȴ��ڵ���̶ȣ�����A����
B���������ж�ʱ��Ӧ���ü������ʻ��⣬̼�����������������ϣ�����̼����������ز��飬��B����
C��pH��7.00��ѪҺ��c(H2CO3)��c(HCO3��)����C����
D��ˮ�����ӻ�����ֻ���¶��йأ�����Һ��������أ���D��ȷ����ѡD��
���㣺����������ʵĵ��롢��������Ե���ƽ���Ӱ�졢����ˮ���Լ����ӻ��������жϵ�


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2013?���϶�ģ������ѪҺ���������ƽ�⣺CO2+H2O?H2CO3
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| T/�� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |

| OH- |
| H+ |
| c��HCO3-����c��H2CO3�� | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�챱����������������ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ���ѡ��
����ѪҺ�������Ҫ�����ƽ�⣺ ��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3��)��c(H2CO3)�仯��ϵ���±���
��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3��)��c(H2CO3)�仯��ϵ���±���
| c(HCO3��) ��c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�걱����������������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ѪҺ�������Ҫ�����ƽ�⣺ ��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3��)��c(H2CO3)�仯��ϵ���±���
��ʹ����ѪҺpH������7.35��7.45������ͻᷢ�����ж�����ж�����pH��c(HCO3��)��c(H2CO3)�仯��ϵ���±���
|
c(HCO3��) ��c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
|
pH |
6.10 |
7.35 |
7.40 |
7.45 |
����˵������ȷ����
A����������ѪҺ�У�HCO3����ˮ��̶ȴ��ڵ���̶�
B������ѪҺ���ж�ʱ����ע��NaHCO3��Һ����
C��pH=7.00��ѪҺ�У�c(H2CO3)��c(HCO3��)
D��pH=7.40��ѪҺ�У�HCO3����ˮ��̶�һ������H2CO3�ĵ���̶�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com