
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:
CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO2)/mol | H2/ mol |
0 | 1.50 | 1.00 |
t1 |
| 0.40 |
t2 | 0.90 |
|
下列说法不正确的是
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
BD
【解析】
试题分析:A、反应在t1 min内,氢气的物质的量减少0.6mol,则水蒸气的物质的量增加0.6mol,浓度增加0.6mol/L,所以t1 min内平均速率为v(H2O)=0.6mol/L/t1 min=0.60 /t1 mol·L-1·min-1,正确;B、由表中所给数据可计算t1 min时n(CO2)=0.9mol,与t2min时的n(CO2)相等,说明t1 min时反应已达平衡状态,计算该温度下的化学平衡常数K=1,而800℃,上述反应平衡常数为1.56,升高温度,平衡常数增大,说明升高温度,平衡正向移动,正向是吸热反应,错误;C、保持其他条件不变,向平衡体系中再通入1.00 molH2,则会增大CO2转化率,而本身的转化率降低,H2的体积分数增大 ,正确;D、保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,反应从逆反应开始,因为该反应的平衡常数为1,可计算达平衡时CO转化的浓度是0.6mol/L,所以到达平衡时,c(CO2)=0.60 mol/L,错误,答案选BD。
考点:考查反应速率的计算,平衡常数的计算,热效应的判断,物质浓度的计算


科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
简单原子的原子结构可用下图形象地表示,其中?表示质子,○表示中子:①; ②
② ;③
;③ 。则下列有关这三种原子的叙述中正确的是
。则下列有关这三种原子的叙述中正确的是
A.属于不同的元素 B.具有相同的质量数 C.具有不同的核电荷数 D.化学性质相似
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
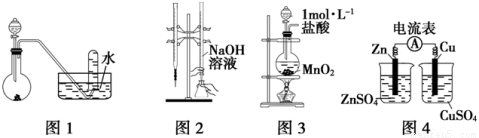
A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置检验电流的方向
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1, ①
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1, ②
①热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4 。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
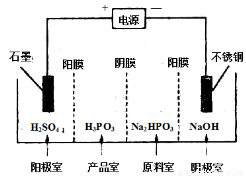
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rX>rY> rW >rQ
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.元素Q和Z能形成QZ2型的共价化合物
D.Z元素的氢化物稳定性大于W元素的氢化物稳定性
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl-
B.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl-
C.甲基橙显黄色的溶液: Na+、CO32-、NO3-、SO32-
D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.常温常压下,32 g 甲醇中含有的C—H键的数目为4NA
B.标准状况下,11.2 L 甲醛中含有的电子数目为8NA
C.0.1 mol N2与0.3 mol H2在一定条件下充分反应,生成的氨分子数目为0.2NA
D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中,含有的阳离子数目为0.02NA
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
下列物质互为同分异构体的一组是
A.35Cl和37ClB.CH3CH2OH和CH3OCH3
C.O2和O3 D.H2O和H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com