
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش��������⣺

��1����Ũ��������ʵ���Ũ��Ϊ___________mol/L��
��2��ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����________��
A.��Һ��HCl�����ʵ��� B.��Һ��Ũ��
C.��Һ��Cl������Ŀ D.��Һ���ܶ�
��3��ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.3 mol/L��ϡ���ᡣ
�ٸ�ѧ����Ҫ����Ͳ��ȡ___________ mL����Ũ����������ơ�
������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ�__________��
A.��Լ30mL����ˮϴ���ձ��Ͳ�����2��3�Σ�ϴ��Һ��ע������ƿ����
B.����Ͳȷ��ȡ����Ũ���������������ر���ע��ʢ������ˮ��Լ30mL�����ձ��У��ò���������������ʹ���Ͼ���
C.������ȴ�������ز�����ע��500mL������ƿ��
D.������ƿ�ǽ������µߵ�ҡ��
E.���ý�ͷ�ιܼ�����ˮ��ʹ��Һ��Һ����ʹ�ǡ����̶�������
F.����������ƿ��С�ļ�����ˮ��ֱ��Һ��ӽ��̶���1��2cm��
�������ƹ����У�����ʵ������������������Ũ���к�Ӱ�죿������ƫ�ߡ�ƫ�ͻ���Ӱ������գ���
I������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��____________��
II������Ͳ��ȡŨ�����ϴ����Ͳ2~3�Σ�ϴ��ҺҲת�Ƶ�����ƿ_________��
III����Һע������ƿǰû�лָ������¾ͽ��ж���____________��
���𰸡� 12 BD 12.5 B C A F E D ƫ�� ƫ�� ƫ��
����������1������![]() �����Ը�Ũ��������ʵ���Ũ��Ϊ
�����Ը�Ũ��������ʵ���Ũ��Ϊ![]() ����2����Һ���о�һ�ȶ��ԣ���Һ��Ũ�ȡ��ܶ�����ȡ��Һ������أ�����n=cV��֪��Һ��HCl�����ʵ�������Һ��Cl������Ŀ������Һ������йأ���ѡBD����3���ٸ���ϡ���������ʵ����ʵ��������֪��ѧ����Ҫ����Ͳ��ȡŨ��������Ϊ
����2����Һ���о�һ�ȶ��ԣ���Һ��Ũ�ȡ��ܶ�����ȡ��Һ������أ�����n=cV��֪��Һ��HCl�����ʵ�������Һ��Cl������Ŀ������Һ������йأ���ѡBD����3���ٸ���ϡ���������ʵ����ʵ��������֪��ѧ����Ҫ����Ͳ��ȡŨ��������Ϊ![]() ��������һ�����ʵ���Ũ����Һ��һ�㲽��Ϊ�����㡢�������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȣ�������ȷ��˳��ΪBCAFED����I������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ�棬Ũ�����������٣�Ũ��ƫ����II������Ͳ��ȡŨ�����ϴ����Ͳ2~3�Σ�ϴ��ҺҲת�Ƶ�����ƿ�У����ʵ����ʵ������ӣ�Ũ��ƫ����III����Һע������ƿǰû�лָ������¾ͽ��ж��ݣ��ָ�������ʱ����Һ�����ƫС����Һ��Ũ��ƫ����
��������һ�����ʵ���Ũ����Һ��һ�㲽��Ϊ�����㡢�������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȣ�������ȷ��˳��ΪBCAFED����I������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ�棬Ũ�����������٣�Ũ��ƫ����II������Ͳ��ȡŨ�����ϴ����Ͳ2~3�Σ�ϴ��ҺҲת�Ƶ�����ƿ�У����ʵ����ʵ������ӣ�Ũ��ƫ����III����Һע������ƿǰû�лָ������¾ͽ��ж��ݣ��ָ�������ʱ����Һ�����ƫС����Һ��Ũ��ƫ����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ� 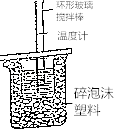
�Իش��������⣺
��1����С�ձ���������ֽ������������
��2�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ�����ƫ����ƫС������Ӱ�족��������ճ������ʵ�ʸ�ʵ��������Ч�����ã�
��3��ʵ���и���60mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������������ȡ���������ȡ������������ɣ���
��4������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ������50mL 0.5mo1L��1NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�����ƫ����ƫС������Ӱ�족��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL�Ļ��Һ�У��������������ʵ���Ũ�ȷֱ���0.3molL��1��0.15molL��1 �� ��û��Һ�м���2.56gͭ�ۣ����ȣ�����ַ�Ӧ��������Һ��ͭ���ӵ����ʵ���Ũ���ǣ� ��
A.0.15 molL��1
B.0.225 molL��1
C.0.30 molL��1
D.0.45 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������Һ�д����������
A. H+��Ca2+��Cl-��CO32�� B. Na+��Mg2+��SO42-��OH-
C. K+��Na+��OH-��Cl- D. Cu2+��Ba2+ ��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹�м���������������Ϊ1:2ʱ��ը�����������ʱ������������������Ϊ
A. 1:2 B. 1:4 C. 1:1 D. 2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϸ�Ķ����⣬����Ҫ�����
��1�������ʵ���Ũ����ͬ�� �ٰ�ˮ ���Ȼ�� ��̼����� ��������� ������� ������Һ��c��NH4+����С��˳���ǣ�����ţ� II���Ҷ����������ᣬ�����ǻ�ѧѧϰС���ͬѧ�Բ��ᾧ�壨H2C2O4xH2O�����е�̽����ѧϰ�Ĺ��̣�������벢Э������������ѧϰ����
����ͬѧ���о������ǣ�̽���ⶨ���ᾧ�壨H2C2O4xH2O���е�xֵ��ͨ���������Ϻ������Ѱ�ã�����������ˮ��ˮ��Һ����������KMnO4��Һ���еζ���
2MnO ![]() +5H2C2O4+6H+�T2Mn2++10CO2��+8H2O
+5H2C2O4+6H+�T2Mn2++10CO2��+8H2O
ѧϰС���ͬѧ����˵ζ��ķ����ⶨxֵ��
�ٳ�ȡ1.260g�����ᾧ�壬�����Ƴ�100.00mLˮ��ҺΪ����Һ��
��ȡ25.00mL����Һ������ƿ�У��ټ���������ϡH2SO4 ��
����Ũ��Ϊ0.1000molL��1��KMnO4����Һ���еζ����ﵽ�յ�ʱ����10.00mL��
�ζ�ʱ��������KMnO4��Һװ����ͼ�е�����ס����ҡ����ζ����У�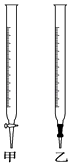
��2����ʵ��ζ��ﵽ�յ�ı�־������ ��
��3��ͨ���������ݣ����x= �� ���ۣ������ζ��յ�ʱ���ӵζ��̶ܿȣ����ɴ˲�õ�xֵ�����ƫ����ƫС�����䡱����ͬ����
�����ζ�ʱ���õ�����KMnO4��Һ����ö�����Ũ�ȱ�С�����ɴ˲�õ�xֵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3.9�˵�þ���Ͻ�Ͷ�뵽500mL 2mol/L�������У�������ȫ�ܽ⣬�ټ���4mol/L������������Һ����Ҫ���ɳ�����࣬������������������Һ�������()
A��125mL B��200mL C��250mL D��560mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڵ���ʲ��ܵ����������
A. ���� B. KNO3 ��Һ C. FeC13 ���� D. ���ڵ�Na2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com