
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | |
| 2 | ③ | ④ | ||||||
| 3 | ② | ⑥ | ⑦ | ⑤ | ||||
| ||
| ||
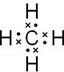 ,为正四面体构型,故答案为:
,为正四面体构型,故答案为: ;正四面体;
;正四面体; ;
;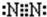 ;
; ;
;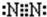 ;碱石灰;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2:3;
;碱石灰;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2:3;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
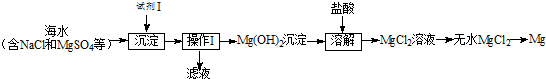
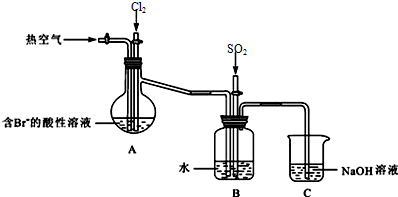
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂 | 离子方程式 | |
| ①NaHCO3溶液(Na2CO3) | ||
| ②Fe2O3(Al2O3) | ||
| ③FeCl3溶液(FeCl2) | ||
| ④CO2(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
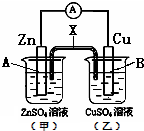
| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn |
| C、若X是石墨条,则乙池溶液的pH会减小 |
| D、若X是锌条,则A电极的质量会增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com