

| A. | (2) | B. | (4) | C. | (3) | D. | (5) |
分析 作原电池负极和电解池阳极的金属易被腐蚀,作原电池正极或电解池阴极的金属易被保护,金属腐蚀快慢顺序是:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答 解:根据图知,②③装置是原电池,在②中,金属铁做负极,③中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以②>③,
④⑤装置是电解池,④中金属铁为阴极,⑤中金属铁为阳极,阳极金属被腐蚀速率快,阴极被保护,即⑤>④,
根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,
所以铁腐蚀快慢顺序为:⑤②①③④,所以铁腐蚀最快的是⑤,最慢的是④,
故选D.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极或电解池阳极的金属易被腐蚀,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 溶于水后加石灰水,看有无沉淀 | |
| B. | 加稀盐酸观察是否有气体产生 | |
| C. | 溶于水后加CaCl2溶液,看有无沉淀 | |
| D. | 在无色火焰上灼烧,观察火焰是否呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA | |
| B. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA | |
| C. | 常温常压下,20g D2O含有的原子总数为3NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合气体中分子总数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠将二氧化碳氧化成氧气 |
| B | 向Fe2(SO4)3溶液中加入铜粉,溶液变蓝色 | Cu2+的氧化性比Fe3+的弱 |
| C | 将表面有Ag2S的银首饰放在含食醋的铝锅中煮沸,首饰变得光亮 | 铝置换出银 |
| D | 向NaClO和NaOH混合溶液中加入H2O2浓溶液产生大量气体 | 碱性条件下,ClO-被还原为Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使溴水、酸性高锰酸钾溶液褪色,其反应类型相同 | |
| B. | 某烷烃R的相对分子质量为86,其氯代物只有2种,则R的名称一定为2,3-二甲基丁烷 | |
| C. | 若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物只有CHCl3 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
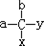 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )| A. | 苹果酸: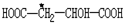 | B. | 丙氨酸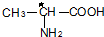 | C. | 葡萄糖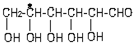 | D. | 甘油醛 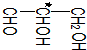 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸和氯氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 碳酸钠与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | Ca(NO3)2溶液和Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com