
| 序号 | 实验现象 | 解释和结论 |
| ① | 钠浮在水面上 | 钠的密度比水小 |
| ② | 钠熔成小球 | 钠与水反应放热且钠的熔点低 |
| ③ | 钠四处游动,嘶嘶作响 | 产生了氢气 |
| ④ | 向反应后的溶液中滴加酚酞,溶液变红 | 生成了碱性物质 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
分析 钠的密度小于水,熔点低,质软,与水剧烈反应生成氢氧化钠和氢气,现象总结为:浮水面、熔小球、乱游动、嘶嘶响,以此解答该题.
解答 解:①钠的密度小于水,钠投入水中并浮在水面上,故正确;
②钠与水反应放出大量热,而且钠的熔点较低,所以钠会熔化成一个闪亮的小球,反应生成大量的气体推动钠小球四处游动,生成氢氧化钠溶于水,故正确;
③钠与水剧烈反应,生成气体,所以会发生嘶嘶响声,现象不能说成氢气,故错误;
④钠与水反应生成氢氧化钠和氢气,其反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,溶液显碱性,所以反应后溶液由无色变为红色,故正确;
故选B.
点评 本题考查钠的性质,注意把握钠的物理性质和化学性质,根据反应现象判断可能具有的性质为化学常用方法,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 含Hg2+的废水--加入Na2S等沉淀剂 | |
| B. | 钢铁厂的酸性废水--加入熟石灰等进行中和 | |
| C. | 餐饮业厨房含油污水--加工为生物柴油进行利用 | |
| D. | 被细菌、病毒污染的饮用水--加入明矾等进行消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1 mol K2SO4 | |
| B. | 水的体积为2L | |
| C. | K+的物质的量浓度为0.2 mol/L | |
| D. | 取出1 L溶液后,浓度变为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
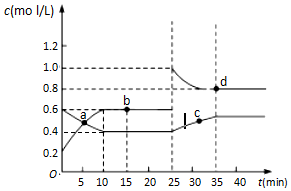 已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )
已如NO2与N2O4相互转化:2NO2(g)?N2O4(g)△H=-24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图.下列分析合理的是( )| A. | 前l0min内,用v(NO2)表示的该反应速率为0.02mol/(L•min) | |
| B. | 反应进行到l0 min时,体系吸收的热量为9.76 kJ | |
| C. | b点的速率大于c点的速率 | |
| D. | 25min时,导致平衡移动原因是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸有强氧化性,不可贮存在铝、铁容器中 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 稀释浓硫酸时,应将水沿着器壁慢慢加入到浓硫酸中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶转移液体时,玻璃棒下端伸入到容量瓶刻度线以下 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在已湿润的pH试纸上,测定该溶液的pH | |
| C. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度 稳定后记下温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com