
�Ҵ�����Ҫ�Ļ�����Ʒ��Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���
![]() ��2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25��ʱ��K=2.95��1011
��2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25��ʱ��K=2.95��1011
![]() ��2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25��ʱ��K=1.71��1022
��2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25��ʱ��K=1.71��1022
��1��д����Ӧ�ٵ�ƽ�ⳣ������ʽK= ��
��2��������ͬʱ����Ӧ���뷴Ӧ����� ��ת���̶ȸ������ ����CO2Ϊԭ�Ϻϳ��Ҵ����ŵ��� ��д��һ�����ɣ���
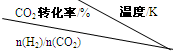
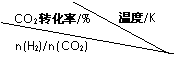 ��3����һ��ѹǿ�£���÷�Ӧ�ٵ�ʵ���������±��������������ݻش��������⣺
��3����һ��ѹǿ�£���÷�Ӧ�ٵ�ʵ���������±��������������ݻش��������⣺
| 500 | 600 | 700 | 800 | |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
���¶����ߣ�Kֵ �����������С�������䡱����
 �������̼��[n��H2��/n��CO2��], Kֵ �����������С�������䡱�����������Ҵ�
�������̼��[n��H2��/n��CO2��], Kֵ �����������С�������䡱�����������Ҵ�
�������������������
��4������ͼ������ϵ����ͼ˵��ѹǿ�仯�Է�Ӧ�ٵĻ�ѧƽ���
Ӱ�졣����ͼ�к����ꡢ������ĺ�������Ҫ�ı�ע��
��5���£�N2H4����NO2��Ӧ����N2��ˮ����������ͬ�����Ҵ���
O2ȼ������CO2��ˮ�������������ܸ��࣬���³���Ϊ���ܻ��ȼ�ϡ�
��֪��N2 (g)+2O2(g)===2NO2(g) ��H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) ��H= ��534.0kJ/mol
���������������Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽΪ�� ��
 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

 CH3OH��g��+H2O��g����H=-��n-m��kJ?mol-1
CH3OH��g��+H2O��g����H=-��n-m��kJ?mol-1 CH3OH��g��+H2O��g����H=-��n-m��kJ?mol-1
CH3OH��g��+H2O��g����H=-��n-m��kJ?mol-1
| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2.95��1011
CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2.95��1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ���¶����ߣ�Kֵ
���¶����ߣ�Kֵ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� |
| ���� |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2.95��1011
CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2.95��1011 CH3CH2OH��g��+H2O��g�� 25��ʱ��K=1.71��1022
CH3CH2OH��g��+H2O��g�� 25��ʱ��K=1.71��1022| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| �¶�/Kn��H2��/n��CO2��CO2ת����/% | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ�䣨S��Ũ�� | 0 | 20 | 40 | 60 | 80 | 100 |
| c��A��mol?L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c��B��mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |

| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2.95��1011
CH3CH2OH��g��+3H2O��g�� 25��ʱ��K=2.95��1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �Ҵ�����Ҫ�Ļ�����Ʒ��Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���
�Ҵ�����Ҫ�Ļ�����Ʒ��Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���| ���� |
| ���� |
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com