
(12��)�������ƿ������ڸ��Ƶر�ˮ�ʡ��������ؽ������ӷ�ˮ�������ೱ��Ҳ������Ӧ�������ȡ���ҵ�������������Ƶ���Ҫ�������£�
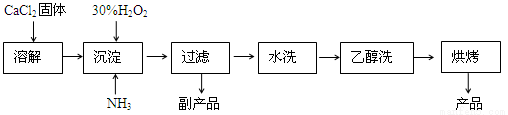
��֪CaO2��8H2O�ʰ�ɫ������ˮ��������350�����ҿ�ʼ�ֽ�ų�������
��1��������������ȡCaO2��8H2O�Ļ�ѧ����ʽ�� ��
��2������ʱ���ñ�ˮ�����¶���0�����ң������ԭ����(д������)��
�� ���� ��
��3���ⶨ��Ʒ��CaO2�ĺ�����ʵ�鲽���ǣ�
��һ����ȷ��ȡa g��Ʒ��������ƿ�У�������������ˮ������b g KI���壬�ٵ�������2 mol/L��H2SO4��Һ����ַ�Ӧ��
�ڶ�������������ƿ�м��뼸�ε�����Һ��
����������μ���Ũ��Ϊc mol��L-1��Na2S2O3��Һ����Ӧ��ȫ������Na2S2O3��ҺV mL��
����֪��I2+2S2O32-=2I-+S4O62-��
��CaO2����������Ϊ (����ĸ��ʾ)��
��ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�CaO2�������������� (�����Ӱ�족����ƫ�͡���ƫ�ߡ�)��ԭ���� ��
��12�֣�
��1��CaCl2+H2O2+2NH3+8H2O = CaO2��8H2O��+2NH4Cl ��2�֣�
��2�����¶ȵͿɼ��ٹ�������ķֽ⣬��߹�������������ʣ�2�֣�
�ڸ÷�Ӧ�Ƿ��ȷ�Ӧ���¶ȵ����������CaO2��8H2O���ʣ�2�֣�
��3����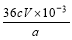 ��2�֣�
��2�֣�
��ƫ��(2��)�������������¿����е�O2Ҳ����KI����ΪI2��ʹ���ĵ�Na2S2O3
���࣬�Ӷ�ʹ��õ�CaO2����������ƫ�ߡ�(2��)
��������
�����������1�������̿�֪����Ӧ��Ϊ�Ȼ��ơ�˫��ˮ��������ˮ������ΪCaO2?8H2O���Ȼ�泥���Ӧ�Ļ�ѧ����ʽΪ��CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O��+2NH4Cl��
��2���������¶Ƚϸ�ʱ˫��ˮ���ֽ⣬�����¶ȵͿɼ��ٹ�������ķֽ⣬��߹�������������ʡ�
�ڸ÷�Ӧ�Ƿ��ȷ�Ӧ���¶Ƚ��������ڷ�Ӧ������Ӧ�����ƶ��������¶ȵ����������CaO2��8H2O���ʡ�
��3���ٹ������������⻯�����ɵĵⵥ�ʣ�����������Ƶζ�ʱ�����ĵ���������Ƶ����ʵ���Ϊ��cmol?L-1��V��10-3L=cV��10-3mol������������ԭ��Ӧ�е����غ㼰���з�Ӧ����ʽ�ɵù�ϵʽ��CaO2��I2��2S2O32-���������Ƶ����ʵ���Ϊ��n��CaO2��=1/2n��S2O32-��=1/2��cV��10-3mol��������Ʒ��CaO2����������Ϊ��1/2��cV��10-3mol��72g/mol��ag=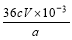
�ڵ���������̫���������е�������������Һ�������������¿����е�O2Ҳ����KI����ΪI2��ʹ���ĵ�Na2S2O3���࣬�Ӷ�ʹ��õ�CaO2����������ƫ�ߡ�
���㣺���⿼�黯ѧ���̵ķ�����ʵ�鷽������ơ���ѧ����ʽ����ƽ����ѧ���㡣


 ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��ɽ�и���9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���������ͨ��SO2ǰ����ܴ����������
A��Ba2+��K+��Br����Cl�� B��Na+��Cu2+��OH����SiO32��
C��NH4+��Al3+��Br����AlO2�� D��Li+��H+��NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��ɽ�е���У����������һѧ�ڻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������������ȷ���ǣ� ��
A��18g��ˮ(D2O)�����ĵ�����Ϊ10NA
B��22.4LCl2ͨ��ˮ�г�ַ�Ӧ����ת��NA������
C��1L 1mol��L-1 NaF��Һ��F������ĿС��NA
D��25�� ʱ��pH��13��1.0L Ba(OH)2��Һ�к��е�OH����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��У������ѧ�ڵ�һ���������ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣��Ӵֲ�Ʒ����п�����ȥ����ͭ���ӵȿ����������Σ��Ӷ��õ�����������п��ʵ���������£�
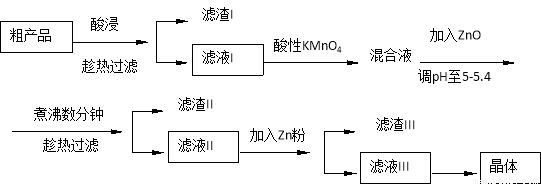
����������������������ʽ��ȫ����ʱ��Һ��pH�μ��±�����ش��������⣺
������ | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Cd(OH)2 | Mn(OH)2 |
pHֵ | 8.0 | 9.7 | 3.2 | 6.7 | 9.4 | 10.4 |
(1)������������У�Ϊ���п�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�� ����дһ�֣��� �������ʱ�ʵ���������ˮ��ԭ���� ��
(2)��ҺI��������KMnO4������Ϊ__________ ____________������ZnO��ԭ���� ��
(3)����III�ijɷ���Ҫ�� ��
(4)����ҺIII�õ�����IJ�������Ϊ ����ȴ�ᾧ���������ӡ�С�ĸ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ��У������ѧ�ڵ�һ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Y������������������������ȡ�����˵����ȷ����
|
| X |
|
Y | Z |
| W |
A��ԭ�Ӱ뾶��Y<Z<W
B����̬�⻯����ȶ��ԣ�X>Z
C��W�������������ˮ��Ӧ�γɵĻ����������ӻ�����
D��X����̬�⻯���ˮ��Һ����Y������������Ӧˮ�������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����Һ��ͨ��������SO2���������������������
��NaClO ��C6H5ONa ��Na2S ��BaCl2 ��Ba(OH)2 ��H2O2
A���٢ܢ� B���٢ڢ� C���ܢݢ� D���٢ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������ܴﵽԤ��ʵ��Ŀ�ĵ���
| ʵ��Ŀ�� | ʵ����� |
A | ����CO32-�� SO42- | �ֱ���뱥��CaCl2��Һ |
B | �Ƚ�Al��Fe�Ľ������ | �ֱ����ŨNaOH��Һ |
C | �Ƚϱ��Ӻ���������� | �ֱ����NOH��Һ |
D | �Ƚ�AgCl��AgI���ܽ�� | ��AgCl�ı���Һ�м�����KI��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ������ѧ�ڵڶ����¿�������ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں���0.078 mol FeSO4����Һ��ͨ��0.009 mol Cl2���ټ��뺬��0.01 molX2O72?����Һ��Fe2+ǡ����ȫת��ΪFe3+����Ӧ��XԪ�صĻ��ϼ�Ϊ
A��+2 B��+3 C��+4 D�� +5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��ɽ��ʡ�����и�����ѧ������������ѧ�Ծ���A���������棩 ���ͣ������
��8�֣�I��ú̿����FeS2��ʽ���ڵ�������ˮ�Ϳ�������������������·�������������ԭ��Ӧ���йط�Ӧ�����ӷ���ʽ����Ϊ��
��2FeS2+7O2+2H2O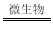 4H++2Fe2++4SO42��
4H++2Fe2++4SO42��
��Fe2++O2+H+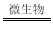 Fe3++____________��
Fe3++____________��
��FeS2+2Fe3+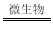 3Fe2++2S��
3Fe2++2S��
��2S+3O2+2H2O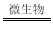 4H++2SO42����
4H++2SO42����
��֪��FeS2�е���Ԫ��Ϊ��1�ۡ��ش��������⣺
��1�����������غ㶨�ɺ͵���غ㶨�ɣ������������ӷ���ʽ��ƽ������������
��2����Ӧ�۵Ļ�ԭ���� ��
��3���۲�������Ӧ����Ԫ������ת��Ϊ ��ú̿�з��������
II����ҵ���û�ͭ�� CuFeS2��ұ��ͭ������Ʒ��Ҳ��SO2 ��ұ��ͭ�ķ�ӦΪ
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
8Cu + 4FeO + 2Fe2O3 + 16SO2
��CuFeS2�� Fe �Ļ��ϼ�Ϊ��2 ����Ӧ�б���ԭ��Ԫ���� ����Ԫ�ط��ţ���������0.8 molͭʱ���˷�Ӧת�Ƶĵ�����Ŀ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com