
【题目】下列说法不正确的是
A. 对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值
B. 在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变
C. 在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-)
D. 沉淀溶解平衡AgI![]() Ag++ I-的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质
Ag++ I-的平衡常数为8.5×10-17,不能说明难溶盐AgI是弱电解质
科目:高中化学 来源: 题型:
【题目】(1)写出NaHCO3的电离方程式 。
(2)下列物质中:①固体烧碱 ②HCl气体 ③NH3 ④蔗糖 ⑤石墨 ⑥稀硫酸 ⑦熔融KCl ⑧碳酸钙 ⑨Na2O固体;属于非电解质的是 ,能导电的是 。(填编号)
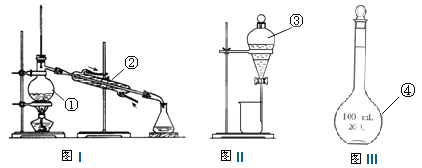
(3)写出仪器名称 ① ② ;仪器①~④中,使用时必须检查是否漏水的 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
(1)请回答:反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.已知反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(2)该反应的平衡常数表达式为K=____________;CO的平衡转化率= _____________。
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
III. 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
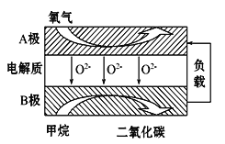
(4)B极上的电极反应式为 。
(5)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的 SO2 和 SO3 相比较,下列结论正确的是( )
A.它们的分子数目之比是4:5
B.它们的氧元素的质量之比为2:3
C.它们的物质的量之比为5:4
D.它们的密度之比为5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol.L-l的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA) +c (HB) +c (HD) =c (OH-) -c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用胆矾晶体(CuSO4·5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题:
(1)所需仪器为:托盘天平、药匙、烧杯、胶头滴管,还需要那些主要玻璃仪器才能完成该实验,请写出: 、 。
(2)请写出该实验的简要的实验步骤:
①计算;②称量胆矾 g;③ ;
④转移;⑤洗涤并转移;⑥定容;⑦摇匀。
(3)如图是该同学转移溶液的示意图,图中的错误是:
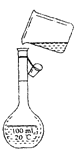
① 、
② 。
(4)在配制CuSO4溶液时,下列操作中会导致结果偏低 (请用序号填写)。
① 用托盘天平称量时砝码放在左盘
② 将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③ 定容时俯视刻度线
④ 定容时仰视刻度线
⑤ 干净的容量瓶未经干燥就用于配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下.10mL0.40mol/LH2O2发生催化分解.不同时刻测定生成O2的休积(己折算为标准状况)如下表。
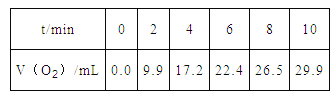
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(Lmin)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(Lmin)
C.反应至6min时,c(H2O2) = 0.30mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,从废水中回收金,并生产一定量的绿矾和胆矾。
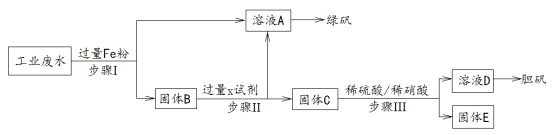
(1)试剂X是 ,固体C的成份是
(2)步骤I,II,III均需要进行的操作是
(3)写出步骤III处发生反应的离子方程式 ,稀硝酸在此反应中的作用是 , 将此过程收集到的NO与O2混合得16mL混合气体充满试管后倒扣水中,恢复原状况剩余气体为2mL,则原混合气体中NO的体积是 。
(4)制备胆矾方法有三种:①铜与混酸(稀硫酸和稀硝酸)的反应②铜与浓硫酸的反应③铜与稀硫酸和氧气的反应.请选出你认为的最佳方法,写出此方法的反应化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com