
已知:CO2(g)
+ 3H2(g)  CH3OH(g)
+ H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
CH3OH(g)
+ H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是

A.升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
B
【解析】
试题分析:正反应是放热反应,升高温度破坏向逆反应方向移动,所以升高温度能使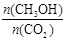 减小,A不正确;根据图像可知,平衡时CO2的浓度是0.25mol/L,所以消耗CO2是1mol/L-0.25mol/L=0.75mol/L,所以反应达到平衡状态时,CO2的平衡转化率为0.75÷1.0=75%,B正确;3 min时,反应还没有达到平衡状态,所以用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,C不正确;消耗氢气的物质的量浓度是0.75mol/L×3=2.25mol/L,所以氢气的反应速率是υ(H2)=2.25mol/L÷10min=0.225 mol•L-1•min-1,D不正确,答案选B。
减小,A不正确;根据图像可知,平衡时CO2的浓度是0.25mol/L,所以消耗CO2是1mol/L-0.25mol/L=0.75mol/L,所以反应达到平衡状态时,CO2的平衡转化率为0.75÷1.0=75%,B正确;3 min时,反应还没有达到平衡状态,所以用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,C不正确;消耗氢气的物质的量浓度是0.75mol/L×3=2.25mol/L,所以氢气的反应速率是υ(H2)=2.25mol/L÷10min=0.225 mol•L-1•min-1,D不正确,答案选B。
考点:考查外界条件对平衡状态的影响、反应速率和转化率的有关计算
点评:在计算反应速率时,经常用到的关系式就是,反应速率之比是相应的化学计量数之比。该关系在判断平衡状态时也经常用到,需要熟练掌握不能灵活运用。


科目:高中化学 来源:2013-2014学年甘肃省武威市高三上学期第五次月考化学试卷(解析版) 题型:选择题
已知:CO2(g) + 3H2(g)  CH3OH(g)
+ H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol
CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g)
+ H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol
CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.10min后,升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1•min-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三上学期期末考试化学试卷(解析版) 题型:选择题
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol
CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol
CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是

A.升高温度能使平衡向正反应方向移动
B.从反应开始到平衡,v(H2)=0.075mol·L-1·min-1
C.3 min时,V(CO2)正 = V(CH3OH)逆
D.反应达到平衡状态时,CO2的平衡转化率为75%
查看答案和解析>>
科目:高中化学 来源:2014届江西省四校高二零班第一次月考化学试卷(解析版) 题型:选择题
已知:CO2(g)
+ 3H2(g)  CH3OH(g)
+ H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
( )
CH3OH(g)
+ H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
( )

A.升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
查看答案和解析>>
科目:高中化学 来源:2013届浙江瑞安中学高二下学期期中考试化学试卷(解析版) 题型:选择题
已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol
CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g)
ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol
CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com