
某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
|
序号 |
实验设计 |
实验观察(主要现象) |
离子方程式 |
解释与结论 |
|
① |
在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 |
Fe +2H+= H2↑+ Fe2+ |
Fe具有还原性 |
|
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 |
滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
|
|
|
③ |
氯化亚铁溶液加 入锌片 |
|
Fe2++ Zn = Fe + Zn 2++ |
|
|
④ |
|
|
|
Fe3+具有氧化性 |
(3)实验记录(在仿照①实验作答,划线部分不必填写)
(4)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A、Cl2 B、Na C、Mg2+ D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因: ;
你将对实验员在配制氯化亚铁溶液时,提出的建议是 。
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂( )
A、KSCN溶液 B、稀盐酸 C、KMnO4 溶液 D、NaOH溶液
(2)试管 (1分)
(3)②2Fe2+ +Cl2=2Fe3+ +2 Cl-(1分)、Fe3++3SCN- = Fe(KSCN)3(1分);Fe2+具有还原性(1分)
③ Fe2+具有氧化性(1分)
④在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片);(1分)
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失(1分)。
(或先加入足量Cu片(或铁粉或锌片),再加入KSCN溶液,无血红色出现);
2Fe3+ +Cu = 2Fe2+ + Cu2+ 或2Fe3+ + Fe = 3Fe2+或2Fe3+ + Zn = 2Fe2+ + Zn 2+或
2Fe3+ + 3Zn = 2Fe +3 Zn 2+(1分)
(4)AD (2分)
(5)氯化亚铁溶液中的Fe2+被氧化(2分);配制氯化亚铁溶液时要加入少量的铁粉(2分)。
(6)C(2分)
【解析】
试题分析:(2)还缺反应容器:试管。
(3)②加入氯水后,Cl2把Fe2+氧化为Fe3+,离子方程式为:2Fe2+ +Cl2=2Fe3+ +2 Cl-,Fe3+与SCN‾发生络合反应:Fe3++3SCN- = Fe(KSCN)3,说明Fe2+具有还原性。
③Fe2++ Zn = Fe + Zn 2+反应中,Fe元素的化合价降低,说明Fe2+具有氧化性。
④要证明Fe3+具有氧化性,先加入KSCN溶液,溶液变红,再加入还原剂,如Cu片(或铁粉或锌片),红色消失,说明Fe3+具有氧化性,根据选择的试剂写出离子方程式。
(4)元素化合价处于中间价态的物质,既有氧化性也有还原性,Cl2、H2O2中Cl元素和O元素处于中间价态,这两种物质既有氧化性也有还原性,故A项、D项正确。
(5)在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,是因为Fe2+具有还原性,被氧化为Fe3+;配制氯化亚铁溶液时加入少量的铁粉,可防止Fe2+被氧化。
(6)Fe2+具有还原性,可使KMnO4溶液褪色,故C项正确。
考点:本题考查实验仪器的选择、离子的检验、离子方程式的书写、实验方案的设计与分析、 物质氧化性和还原性的判断。


科目:高中化学 来源: 题型:阅读理解
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的气体生成 |
Fe+2H+=H2↑+Fe2+ |
Fe具有还原性 |
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 |
Fe2+具有还原性 Fe2+具有还原性 |
| ③ | 氯化亚铁溶液加 入锌片 |
锌片溶解,析出铁,溶液从浅绿色变为无色 锌片溶解,析出铁,溶液从浅绿色变为无色 |
Fe2++Zn=Fe+Zn2+ | Fe2+具有氧化性 Fe2+具有氧化性 |
④ |
在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) 在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) |
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 |
2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ 2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ |
Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省四地六校高一第三次月考化学试卷(带解析) 题型:实验题
(16分)某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
(3)实验记录(在仿照①实验作答,划线部分不必填写)
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 | 铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 | Fe +2H+= H2↑+ Fe2+ | Fe具有还原性 |
| ② | 氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 | | |
| ③ | 氯化亚铁溶液加 入锌片 | | Fe2++ Zn =" Fe" + Zn 2+ | |
| ④ | | | | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高一下学期期末调研考试化学试卷(解析版) 题型:实验题
某化学学习小组欲探究己烷的性质,用己烷进行下利实验:
实验1:
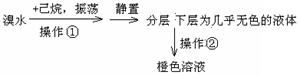
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:根据下图的实验装置进行己烷催化裂化

请回答下列问题:
(1)实验1中用到的玻璃仪器有(填名称) ;
(2)由实验1知己烷的物理性质有 ;
(3)实验2中的橙色溶液逐渐变浅的原因是 ;
A.己烷与溴发生发生取代反应 B.溴代己烷为无色物质
C.液溴向外挥发浓度降低 D.己烷与液溴发生加成反应
E.液溴与己烷分层,密度大的液溴在下层
(4)实验3的装置Ⅱ的作用是 ;
(5)试管C中看到的现象是 ,说明有 生成;
(6)试写出装置Ⅰ中发生有丙烷生成的裂化反应方程式:
。
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高一第三次月考化学试卷(解析版) 题型:阅读理解
(16分)某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
(3)实验记录(在仿照①实验作答,划线部分不必填写)
|
序号 |
实验设计 |
实验观察(主要现象) |
离子方程式 |
解释与结论 |
|
① |
在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 |
Fe +2H+= H2↑+ Fe2+ |
Fe具有还原性 |
|
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 |
滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
|
|
|
③ |
氯化亚铁溶液加 入锌片 |
|
Fe2++ Zn = Fe + Zn 2+ |
|
|
④ |
|
|
|
Fe3+具有氧化性 |
(4)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A、Cl2 B、Na C、Mg2+ D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因: ;
你将对实验员在配制氯化亚铁溶液时,提出的建议是 。
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂( )
A、KSCN溶液 B、稀盐酸 C、KMnO4 溶液 D、NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com