
H![]() H++A2-
H++A2-
回答下列问题:
(1)请判断H
(2)已知0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H
(3)Na
(4)H
(1)强电解质 因为H
(2)< 因H
(3)碱性 A2-+H2O![]() HA-+OH-
HA-+OH-
(4)H++A2-====HA-
解析:(1)由H![]() HA-+OH-,溶液呈碱性。(4)H
HA-+OH-,溶液呈碱性。(4)H


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年江西省高二上学期期中考试化学卷 题型:选择题
下列叙述正确的是( )
A、物质的量浓度相等的H2S和NaHS混合溶液中:

B、相同物质的量浓度的下列溶液中:① 、②
、②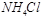 、③
、③ 、
、
④
 由大到小的顺序是:①>②>③>④
由大到小的顺序是:①>②>③>④
C、某二元酸(H2A)在水中的电离方程式是:


 则在NaHA溶液中:
则在NaHA溶液中:
D、pH=12氨水溶液与pH=2盐酸溶液等体积混合:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com