
| A. | 40 mL | B. | 72 mL | C. | 80 mL | D. | 128 mL |
分析 根据电荷守恒计算混合溶液中n(Al3+),向MgCl2和AlCl3的混合溶液加入NaOH溶液,使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=c(Cl-)+n(Al3+),再根据V=$\frac{n}{V}$计算.
解答 解:溶液中氯离子的物质的量为:n(Cl-)=0.2L×1.3mol/L=0.26mol,
溶液中镁离子的物质的量为:n(Mg2+)=0.2mol/L×0.2L=0.04mol,
根据电荷守恒可知溶液中铝离子的物质的量为:n(Al3+)=$\frac{0.26mol-0.04mol×2}{3}$=0.06mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知:n(NaOH)=c(Cl-)+n(Al3+)=0.26mol+0.06mol=0.32mol,
所以至少需要4mol/L氢氧化钠溶液的体积为:$\frac{0.32mol}{4mol/L}$=0.08L=80mL,
故选C.
点评 本题考查物质的量浓度的有关计算,题目难度不大,利用原子守恒可简化解题,明确反应后溶质为NaCl、NaAlO2的混合物为解答关键,试题培养了学生的化学计算能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
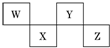
| A. | W、Y可形成两种不同的化合物 | |
| B. | Z的阴离子电子层结构与氩原子的相同 | |
| C. | W的简单氢化物的沸点比Y的氢化物的沸点高 | |
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加AgNO3溶液,观察是否有白色沉淀 | |
| B. | 滴加AgNO3溶液、稀硝酸和NaNO2溶液,观察是否有白色沉淀 | |
| C. | 滴加NaOH溶液,并加热片刻,再用稀硝酸酸化后,滴入AgNO3溶液观察是否有白色沉 | |
| D. | 滴加AgNO3溶液和稀硝酸,观察是否有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-1-丁炔 | B. | 3-甲基-1-丁炔 | C. | 2-甲基-3-丁炔 | D. | 3-甲基-2-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有泥沙的浑水,静置一会儿水沙分离,可取得上层的清水 | |
| B. | 农村“扬谷”分离饱满的谷粒和干瘪的谷壳 | |
| C. | 建筑工地上用铁筛把大小不同的沙粒分开 | |
| D. | 淘米除去米中混有的小沙粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5mol N2中含有0.5NA个N | |
| B. | 32gO2中含有的氧原子数为2NA | |
| C. | H2的摩尔质量是为2 | |
| D. | 1molH2SO4在水溶液电离出离子约为1.806×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
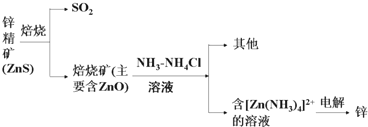
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com