
下列说法正确的是( )
|
| A. | 已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=﹣4b kJ•mol﹣1 |
|
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=﹣270 kJ•mol﹣1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
|
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) |
|
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=﹣393.5 kJ•mol﹣1,②C(s,金刚石)+O2(g)═CO2(g)△H=﹣395.0 kJ•mol﹣1,则C(s,金刚石)═C(s,石墨)△H=﹣1.5 kJ•mol﹣1 |
| 反应热和焓变;热化学方程式.. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A、据燃烧热的概念分析; B、气态物质变成液态时放热; C、合成氨是可逆反应,热化学方程式中的焓变是完全转化时的数值; D、据盖斯定律解答. |
| 解答: | 解:A、燃烧热是指1mol可燃物燃烧放出的热量,故A错误; B、气态物质变成液态时放热,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ,故B错误; C、合成氨是可逆反应,热化学方程式中的焓变是完全转化时的数值,故C错误; D、有已知反应①和②,据盖斯定律②﹣①得:C(s,金刚石)═C(s,石墨)△H=﹣1.5 kJ•mol﹣1,故D正确; 故选D. |
| 点评: | 本题考查了燃烧热、可逆反应的焓变、盖斯定律,题目难度不大. |


科目:高中化学 来源: 题型:
某温度下,向盐A的饱和溶液(质量分数为a%)中加入m克无水盐A,同温下析出n克A·xH2O晶体,则从饱和溶液中析出的溶质质量为(设A式量为M) ( )
A.n×a% B.n-m C.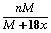 D.(n-m)×a%
D.(n-m)×a%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.常温下,某难溶物的Ksp为2.5×105
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.NH3·H2O溶液加水稀释后,溶液中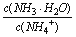 的值增大
的值增大
D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
A.物质Z的化学计量数a = 2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中
只有一种为气态
C.若X、Y均为气态,则在平衡时X的转化率:
Ⅰ﹤Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开
始到平衡所需的时间:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
研究表明,化学反应中的能量变化其本质是化学键的生成或断裂过程中分别会释放与吸收能量.如图表示反应2H2(g)+O2(g)═2H2O(g)的能量变化,下列有关说法中错误的是( )
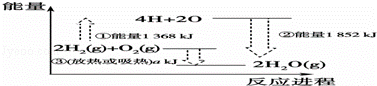
|
| A. | 图中的①是指吸收能量,②是指放出能量 |
|
| B. | 图示说明反应2H2(g)+O2(g)═2H2O(g)是一个吸热反应 |
|
| C. | 图示说明化学键的形成与断裂是物质在化学反应中发生能量变化的主要原因 |
|
| D. | ③中a所指的数值为484 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)⇌2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见表.下列说法正确的是( )
| 温度 | 平衡浓度/(mol L﹣1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 |
|
| A. | 若T2>T1,则该反应的△H<0 |
|
| B. | 向容器中充入N2,H2NCOONH4质量增加 |
|
| C. | NH3体积分数不变时,说明该反应达到平衡 |
|
| D. | T1、T2时,H2NCOONH4转化的△n(T2)=2△n(T1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
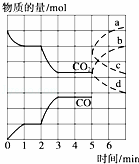
在一个体积为2L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)⇌FeO(s)+CO(g).其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示.
(1)反应在1min时第一次达到平衡状态,固体的质量增加了3.2g.用CO2的浓度变化表示的反应速率v(CO2)= 0.1mol•L﹣1•min﹣1 .
(2)反应进行至2min时,若只改变温度,曲线发生的变化如图所示,3min时再次达到平衡,则△H > 0(填“>”、“<”或“=”).
(3)5min时再充入一定量的CO(g),平衡发生移动.下列说法正确的是 c (填写编号).
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是 b (填写图中曲线的字母编号).
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态: 固体总质量保持不变 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中不正确的是
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 |
|
|
|
A.甲中反应的平衡常数小于乙 B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率: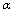 1<
1<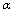 2 =
2 = 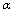 3 D.容器中SO3的物质的量浓度:丙=丁<甲
3 D.容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
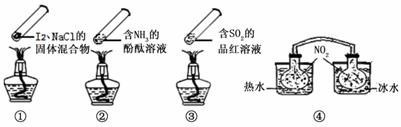
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com