
| A. | NaHCO3比Na2CO3热稳定性差 | |
| B. | NaHCO3比Na2CO3与稀盐酸反应的速度快 | |
| C. | 在相同温度下,Na2CO3的溶解度大于NaHCO3 | |
| D. | Na2CO3能使澄清石灰水变浑浊,而NaHCO3不行 |
分析 A.碳酸氢钠受热易分解;
B.碳酸氢钠与盐酸反应一步完成,而碳酸钠与盐酸反应两步进行;
C.相同条件下,碳酸钠的溶解度大;
D.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠和水.
解答 解:A.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,对热稳定性:Na2CO3>NaHCO3,故A正确;
B.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故B正确;
C.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故C正确;
D.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠和水,二者都能产生沉淀碳酸钙,故D错误;
故选:D.
点评 本题考查了碳酸钠与碳酸氢钠的性质,明确二者性质的差别是解题关键,题目难度不大,注意对基础知识的巩固.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
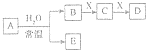 中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )
中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )| A. | 若X是Na2SO3,C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应 | |
| B. | 若A是单质,B和D的反应是OH-+HCO3-═H2O+CO32- 则E-定能还原CuO | |
| C. | 若B、X均为单质,D为CO,C能和E反应,则E为NaOH | |
| D. | 若D为白色沉淀,且与A的摩尔质量相等,则X一定是铝盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅 | B. | 二氧化硅 | C. | 钢 | D. | 铝硅合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、CH4、HF | B. | 红磷、硫、碘 | ||
| C. | CO2、SO2、NO2 | D. | H2SO4、CH3CH2OH、HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是创造新分子和构建新物质的根本手段,我们不能“端起碗吃饭,放下碗就骂娘” | |
| B. | 化妆品是以保持人良状态为目的化学工业品或精细化工品.对于化学,化妆品无异于“空中楼阁” | |
| C. | 科学是把双刃剑,化学在给人类创造巨大财富的同时存在一些负面 影响,无可厚非,不要夸大其词,让人谈“化”色变 | |
| D. | 经济、社会的绿色发展、永续发展,不能走“先发展,后治理”的老路,要考虑、甚至优先考虑生态的可持续发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水的反应:C12+H2O═2H++Clˉ+ClOˉ | |
| B. | 向Al2(SO4)2溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 硫酸氢铵溶液中加入过量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| D. | 铜片加入稀硝酸中:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NH3•H2O | H2SO3 | ||
| 电离平衡常数(mol/L) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com