
【题目】A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号B:________C:________
(2)BA2的电子式____________,BA2分子中化学键属于________键.。
(3)D2A2的化学式___________.
(4)C在元素周期表中的位置是第_______周期,______族,其原子结构示意图为__________
【答案】C Si ![]() 共价 Na2O2 三 ⅣA
共价 Na2O2 三 ⅣA 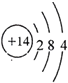
【解析】
A、B、C、D均是短周期元素,A元素族序数是周期数的三倍,A只能处于第二周期,族序数为Ⅵ,故A为O元素;A和B同周期,B原子最外层电子数是内层电子数的二倍,最外层电子数为4,则B为C元素;B和C同族,则C为Si;A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2,则D为Na,据此解答。
(1)由上述分析可知,B为C元素,C为Si元素,故答案为:C;Si;
(2)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为![]() ,CO2分子中化学键属于共价键,故答案为:
,CO2分子中化学键属于共价键,故答案为:![]() ;共价;
;共价;
(3)D为Na元素,A为O元素,D2A2的化学式为Na2O2,故答案为:Na2O2;
(4)C为Si,在元素周期表中的位置是第三周期ⅣA族,其原子结构示意图为 ,故答案为:三;ⅣA;
,故答案为:三;ⅣA;


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是

A. 电池放电时Na+从a极区移向b极区
B. 电极b采用Pt/C,该极溶液的pH增大
C. 该电池a极的反应为BH4-+8OH--8e-===BO2-+6H2O
D. 电池总反应:BH4- + 4H2O2 === BO2- + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中H2、I2各1mol·L-1进行反应H2+ I2![]() 2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
A. 小于30sB. 等于30sC. 大于30sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、CO32-、S2-、SO32-、AlO2-、Cl-、SO42-中的一种或几种,对该溶液进行实验,结果如图:

下列说法不正确的是( )
A. 淡黄色沉淀甲为AgBr,沉淀乙为Al(OH)3
B. 溶液中一定含有Na+、S2-、SO32-、AlO2-
C. 气体甲的成分可能是CO2或SO2或H2S或CO2、SO2的混合气体或CO2、H2S的混合气体
D. 确定溶液A中是否含有SO42-,可在沉淀丙中加入足量稀盐酸,若沉淀部分溶解则溶液A中含有SO42-,若沉淀全部溶解则溶液A中不含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应: ![]()
![]()
![]() ,下列有关说法正确的是
,下列有关说法正确的是
A. 达到化学平衡时,正反应和逆反应的速率都不为零
B. 当O2的浓度不变时,反应达到平衡状态
C. 当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种元素均为短周期主族元素,原子序数依次递增,c元素的单质或含c元素的化合物,焰色反应显黄色,a、b两原子可形成常温下呈液态的的X、Y两种化合物,其中X中a与b原子个数之比为2:1,Y中a与b原子个数之比为1:1,若用a、b、c、d表示它们的单质,单质之间有如下反应:

化合物之间反应:甲+Z→X + d;甲+Y →M。
M常温下是油状液体,它的浓溶液在常温下可用铁或铝制器运输保存。它的浓溶液和另一种酸的浓溶液常用来制炸药,M也用来制磷酸,M还可用于制铅蓄电池。
(1)写出C的元素符号: _________ ,Y的电子式:_______________;
(2)在30%的Y的水溶液中加入MnO2,有大量b的单质气体放出,若在Y、MnO2的混合液中加入稀H2SO4,MnO2被还原成Mn2+ ,仍然产生大量b的单质气体,写出其离子方程式___________________________;
(3)向盛有NaOH和Y的混合液的烧杯中缓缓导入Cl2,产生火光和爆炸声,其中NaOH的作用是_________,对应离子方程式 ____________________________;
(4)由b、c、d三种元素可形成中学化学常见的三种盐丙、丁、戊,其相对分子质量依次增大。戊+M→丁+甲↑+d↓+X,在戊的水溶液中导入甲气体也有d单质的淡黄色沉淀。写出戊和M在水溶液中化学方程式___;
(5)由和M具有相同元素组成的化合物A的分子式为a2d2b8.工业上电解50%的M的水溶液可制得A,发生的反应为:2M![]() A+a2↑,写出阳极电极反应方程式:__________;将A溶液进行稀释又可制得Y。
A+a2↑,写出阳极电极反应方程式:__________;将A溶液进行稀释又可制得Y。
(6)利用c、d两单质之间的反应,可设计一种原电池反应:2C+d![]() C2d,其中正极的电极反应式为:____。
C2d,其中正极的电极反应式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示。下列说法正确的是
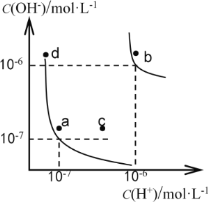
A. 图中对应点的温度关系为: a>b
B. 水的电离常数KW数值大小关系为:b>d
C. 温度不变,加入少量NaOH可使溶液从c点变到a点
D. 在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B![]() C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
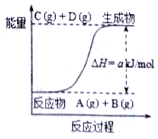
A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com