
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
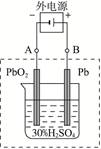
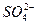
 2PbSO4+2H2O
2PbSO4+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原电池是将化学能转变成电能的装置 |
| B.在原电池中失去电子的一极是阴极 |
| C.原电池的两极一定是由活动性不同的两种金属组成 |
| D.原电池的负极发生的是还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
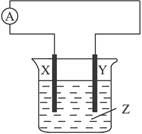
| A.X是Cu,Y是Zn,Z是稀H2SO4溶液 |
| B.X是Zn,Y是C,Z是CuSO4溶液 |
| C.X是Fe,Y是Cu,Z是Fe(NO3)3溶液 |
| D.X是Ag,Y是Zn,Z是AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锌片是正极,铜片上有气泡产生 | B.电流方向是从锌片流向铜片 |
| C.溶液中H2SO4的物质的量减少 | D.电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c>d | B.b>a>d>c | C.c>b>a>d | D.b>a>c>d |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜极为负极 | B.电子从铜沿导线转移到铁 |
| C.铁表面析出金属铜 | D.总反应为Fe + CuSO4 = FeSO4 + Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com