
【题目】(1)某温度下,浓度都是lmol/L的两种单质气体X2和Y2,在密闭容器中反应生成气体Z。达到平衡时,X2、Y2、Z的浓度分别为0.4mol/L、0.8mol/L、0.4mol/L则该反应的化学方程式是____________________________。
(2)298K时,合成氨反应的热化学方程式为N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol,在该温度下,取lmolN2和3molH2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总是小于92.4kJ,其原因是________________________
【答案】![]() 该反应为可逆反应,原料气不可能完全反应,即lmolN2和3molH2放在密闭容器中成氨气的物质的量小于2mol,放出热量小于92.3kJ
该反应为可逆反应,原料气不可能完全反应,即lmolN2和3molH2放在密闭容器中成氨气的物质的量小于2mol,放出热量小于92.3kJ
【解析】
(1)平衡后X2、Y2、Z的浓度分别为0.4mol/L、0.8mol/L、0.4mol/L,相同时间内的浓度变化量之比等于化学计量数之比分析;
(2)根据合成氨的反应为可逆反应,反应物不可能完全转化成生成物判断该反应放出的热量;
(1)平衡后,测得X2、Y2、Z的浓度分别为0.4mol/L、0.8mol/L、0.4mol/L,,相同时间内X2、Y2、Z的浓度变化量分别为(1mol/L-0.4mol/L)=0.6mol/L、(1mol/L-0.8mol/L)=0.2mol/L、(0.4mol/L-0mol/L)=0.4mol/L,X2、Y2、Z的浓度变化量之比=化学计量数之比=3:1:3,即![]() ,根据原子守恒得到:
,根据原子守恒得到:![]() ,故答案为:。
,故答案为:。![]()
(2)N2(g)+3H2(g)2NH3(g);△H=-92.4kJ/mol,可知,生成2mol氨气放出92.3kJ的热量,lmolN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,因为可逆反应不能完全转化,所以生成氨气的物质的量小于2mol,放出热量小于92.3kJ,故答案为:该反应为可逆反应,原料气不可能完全反应,即lmolN2和3molH2放在密闭容器中成氨气的物质的量小于2mol,放出热量小于92.3kJ。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有A、B、C、D四种无色溶液,它们分别是![]() 溶液、
溶液、![]() 溶液、盐酸和
溶液、盐酸和![]() 溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
则:①B是________溶液,C是________。
②常温下若B溶液中![]() 与C溶液中
与C溶液中![]() 相同,B溶液的pH用
相同,B溶液的pH用![]() 表示,C溶液的pH用
表示,C溶液的pH用![]() 表示,则
表示,则![]() ________(填某个数)。
________(填某个数)。
(2)已知某溶液中只存在![]() 四种离子,某同学推测其离子浓度大小顺序可以有以下几种可能:
四种离子,某同学推测其离子浓度大小顺序可以有以下几种可能:
①![]()
②![]()
③![]()
④![]()
则:
(i)上述关系一定不正确的是________(填序号)。
(ii)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为________(填序号)。
(iii)若四种离子浓度关系有![]() ,则该溶液显________(填“酸性”“碱性”或“中性”)。
,则该溶液显________(填“酸性”“碱性”或“中性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
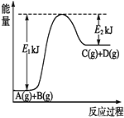
(1)该反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=________kJ/mol (用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量______(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1_______,E2________ΔH______ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出-套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
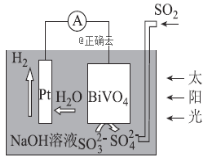
A.该电化学装置中,Pt电极作正极
B.BiVO4电极上的反应式为![]()
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.OH-移向BiVO4电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为____。
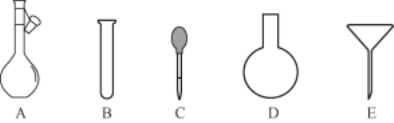
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是___;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的____(填字母代号)。
(3)滴定终点的判定现象是____。
(4)滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/LNH4Fe(SO4)2 标准溶液V mL,则TiO2质量分数表达式为____。
(5)下列操作对TiO2质量分数测定结果偏高的是(______)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出
②若在滴定终点读取滴定管刻度时,俯视标准液液面
③若在滴定时滴定前尖嘴部分有气泡,滴定后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知293K时下列物质的溶度积![]() 单位已省略
单位已省略![]() :
:
| Ag2SO4 | FeS | CuS | Ag2S |
| 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
下列说法正确的是![]()
![]()
A.相同温度下,Ag2SO4、FeS、CuS饱和溶液中:![]()
B.向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:![]()
C.浓度均为0.004mol/L的AgNO3和H2SO4溶液等体积混合后不能产生沉淀
D.向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)

a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com