
【题目】《验方新编》中有如下叙述:“凡暑月身热昏沉,未明症候,恐是出丹。用生白扁豆数粒食之. 如不知腥味,则以生白扁豆、水泡湿,研汁一小杯,调水一盏服之。即愈。”文中涉及的操作方法是
A. 蒸馏 B. 升华 C. 浸取 D. 分液
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.CO2的摩尔质量为44g
B.CO2的摩尔质量等于CO2的相对分子质量
C.1 mol CO2 的质量为44g/mol
D.NA个CO2分子的质量(以克为单位)与CO2的相对分子质量在数值上相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D四种短周期元素,它们的核电荷数依次增大且属于三个周期。A与C, B与D分别是同族元素,C、D同周期,B、D两元素的质子数之和是A、C两元素质子数之和的两倍。
(1)这四种元素是:A______、B______、C______、D______。(填元素符号)
(2)C的单质与A的常见氧化物的反应是______反应(填“吸热”或“放热”)。
(3)A与C可形成离子化合物CA,请写出该物质中阴离子的电子式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物中,只需加入溴水就能一一鉴别的是
A. 已烯、苯、 四氯化碳 B. 已炔、己烯、四氯化碳
C. 已烷、苯、乙醇 D. 甲苯、苯、已烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是含Cr2O72-工业废水的电化学处理示意图。下列说法正确的是(己知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O)
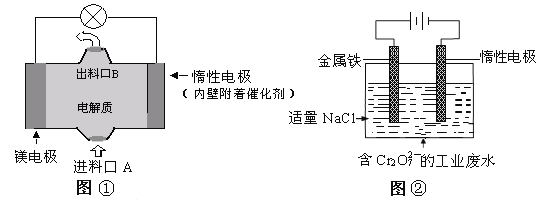
A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②中阳极上的电极反应式为:Fe-3e-=Fe3+
C. 图①中发生的还原反应是:ClO-+H2O+2e-=Cl-+2OH-
D. 若图①中7.2g镁溶解产生的电量用以图②废水处理,理论可产生32.1g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是

A.Y的起始物质的量为0.5 mol
B.该反应的化学方程式为:2X(g)+Y(g) ![]() 3Z(g) H<0
3Z(g) H<0
C.若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存而且为无色透明的溶液是( )
A.NH4+、Al3+、SO42﹣、NO3﹣
B.K+、Na+、NO3﹣、CO32﹣
C.K+、MnO4﹣、NH4+、NO3﹣
D.H+ , K+ , OH﹣ , NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行该反应:2SO2(g)+O2(g)![]() 2SO3(g),已知反应中某一时刻SO2、O2、SO3的浓度为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应中某一时刻SO2、O2、SO3的浓度为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L、O2为0.2mol/L
B. SO2为0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com