
 瘦肉精(Clenbuterol)是一种非常廉价的药品,对于减少脂肪增加瘦肉 (Lean Mass)作用非常好.但它有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病.瘦肉精是白色或类白色的结晶粉末,其结构简式如图,关于瘦肉精下列说法不正确的是( )
瘦肉精(Clenbuterol)是一种非常廉价的药品,对于减少脂肪增加瘦肉 (Lean Mass)作用非常好.但它有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病.瘦肉精是白色或类白色的结晶粉末,其结构简式如图,关于瘦肉精下列说法不正确的是( )| A. | 分子式为C12H18Cl2N2O | |
| B. | 该有机物含羟基、氯原子、氨基、肽键四种官能团 | |
| C. | 该有机物能发生催化氧化反应 | |
| D. | 该有机物核磁共振氢谱有7种类型氢原子的吸收峰 |
分析 由结构简式可知分子式,分子中含2个-Cl、醇-OH、-NH-、-NH2,结合卤代烃、醇及氨基酸的性质来解答.
解答 解:A.由结构简式可知,分子式为C12H18Cl2N2O,故A正确;
B.含羟基、氯原子、氨基,但不含钛键(-CONH-),故B错误;
C.含醇-OH,且与-OH相连的C上含H,则可发生催化氧化反应,故C正确;
D.由结构的对称性可知,苯环上只有1种H,共有7种位置的H,则该有机物核磁共振氢谱有7种类型氢原子的吸收峰,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇的性质及对称性、官能团的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
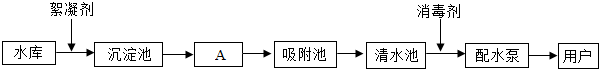
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 NaOH溶液 | B. | 2 mol•L-1HCl溶液 | ||
| C. | 3 mol•L-1 NaCl溶液 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应 2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 石灰石与醋酸溶液反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 溴化亚铁溶液中通入少量氯气2Br-+Cl2═Br2+2C1- | |
| D. | NH4HCO3溶液中加入足量的NaOH溶液:NH+4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学式 | NH3•H2O | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com