
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下:
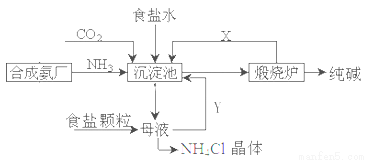
(1)完成有关反应的化学方程式
①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。
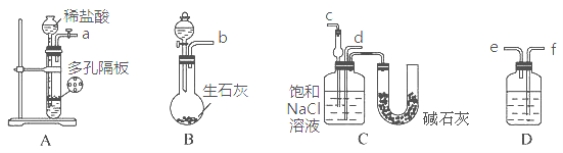
(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
(1)2NaHCO3 Na2CO3+CO2↑+H2O (3分)
Na2CO3+CO2↑+H2O (3分)
(2)C (2分) (3)D (3分)
(4)饱和NaHCO3溶液 (2分) (5)稀HNO3和AgNO3溶液 (2分)
(6)84c(V2- V1)∕1000W (3分)
【解析】
试题分析:(1)煅烧炉中主要是把沉淀池中得到的NaHCO3加热使之分解得到碳酸钠,方程式为2NaHCO3 Na2CO3+CO2↑+H2O;(2)联合制碱法的生产原料为:食盐、NH3、CO2,A正确;副产物氯化铵可做氮肥,正确;生产过程中可循环利用的物质除CO2外,还有NaCl,错误;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,正确。(3)“联合制碱法”的第一步反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故模拟装置中接口连接顺序为b接c;a接f、e接d;(4)D装置的作用是除去CO2中混有的HCl,可选用饱和NaHCO3溶液;(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加稀HNO3和AgNO3溶液;(6)根据所给信息可知,样品中NaHCO3的物质的量为c(V2-V1)/1000 mol,故纯碱样品中NaHCO3质量分数为84c(V2- V1)∕1000W。
Na2CO3+CO2↑+H2O;(2)联合制碱法的生产原料为:食盐、NH3、CO2,A正确;副产物氯化铵可做氮肥,正确;生产过程中可循环利用的物质除CO2外,还有NaCl,错误;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,正确。(3)“联合制碱法”的第一步反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故模拟装置中接口连接顺序为b接c;a接f、e接d;(4)D装置的作用是除去CO2中混有的HCl,可选用饱和NaHCO3溶液;(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加稀HNO3和AgNO3溶液;(6)根据所给信息可知,样品中NaHCO3的物质的量为c(V2-V1)/1000 mol,故纯碱样品中NaHCO3质量分数为84c(V2- V1)∕1000W。
考点:考查钠及其化合物的性质以及氯离子的检验。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
(13分)【化学—物质结构与性质】
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。
(1)N原子价电子轨道表示式 ;
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同。PCl5晶体类型是 ;PCl4+的空间构型是 ;
(3)PCl6-呈正八面体的结构(如图),该离子中 (填“是”或“否”)存在配位键,原因是 ;

(4)NCl3分子中,N原子杂化方式是 ;NCl3不稳定,易发生分【解析】
2NCl3(l)=N2(g)+3Cl2(g),分解过程中形成σ键和π键数目之比为 ;
(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
下列离子反应方程式能正确表达相关反应的是
A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.用石墨电极电解氯化镁溶液:2Cl-+2H2O电解Cl2↑+H2↑+2OH-
C.向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
D.等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合:
3HCO3-+2Ca2++3OH-=2CaCO3↓+CO32-+3H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:选择题
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法不正确的是
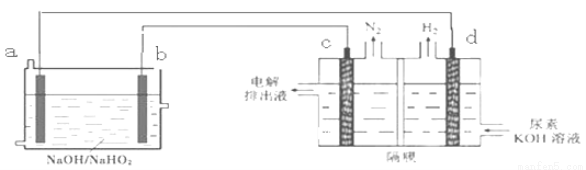
A.燃料电池的总反应为:2Al+3HO2- = 2AlO2- + OH- +H2O
B.电极b是正极,且反应后该电极区pH增大
C.电解过程中,电子的流向由a→b→c→d.
D.电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州市高三5月综合练习理综化学试卷(解析版) 题型:填空题
(15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:
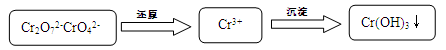
(1)加酸可以使CrO42-转化为Cr2O72-: 2CrO42- + 2H+ 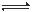 Cr2O72- + H2O
Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol?L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K= 。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为 。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol?L-1,溶液的pH应升高到 。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的 极。
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为 。往100.00mL 0.1000 mol?L-1CrCl3溶液滴加1.000mol?L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图:
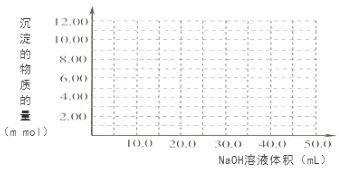
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各组分子中,都属于含有极性键的非极性分子的一组是( )
A.CO2、H2O B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列各组物质的晶体中化学键类型相同,晶体类型也相同的是
A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.NaOH和CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com