
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
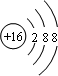

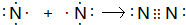
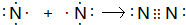
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 HCN+OH-
HCN+OH- HCN+OH-
HCN+OH-

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

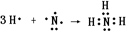
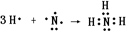
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出三种元素的名称:X_____________,Y_______________,Z________________。
(2)两种氧化物分别为________________和________________。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,其离子方程式为_______________________。
(4)X与Y形成的化合物熔点比Z与Y形成的化合物熔点___________(填“高”或“低”),其中原因是_____________________________________________________________________。
(5)用电子式表示Y的质量分数58.97%的氧化物的形成过程:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com